
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Свойства р-элементов VII группы
|
|
Электронные формулы элементов, степени окисления. Характер изменения энергии ионизации, сродства к электрону, радиусов атомов при переходе от фтора к йоду. Строение молекулы F2 по методам ВС и МО.
Изменение энергии связи в ряду F2 – I2. Изменение окислительных свойств в ряду F2 – I2. Промышленные и лабораторные способы получения галогенов. Химические свойства: отношение к воде, щелочам, металлам и неметаллам. Особенности химических свойств фтора.
Галогеноводороды. Изменение полярности связи в ряду газообразных молекул HF – HI. Ассоциация молекул HF в растворе, объяснение аномалии в температуре кипения HF. Способы получения и химические свойства галогеноводородов.
Окислительно-восстановительные и кислотные свойства галогеноводородов в их водных растворах. Реакции травления стекла. Соляная, бромистоводородная и йодистоводородная кислоты, их свойства.
Галогениды. Классификация их по типу химической связи и кислотно-основным свойствам. Гидролиз галогенидов. Свойства галогенид-ионов.
Кислородные соединения хлора. Термодинамический анализ возможности взаимодействия хлора с кислородом с образованием оксидов хлора (I, IV, VII).
Кислородсодержащие кислоты хлора. Изменение устойчивости, кислотных и окислительно-восстановительных свойств в ряду кислородсодержащих кислот хлора. Способы получения кислот и их солей. Возможные схемы термического разложения кислот и солей. Белильная известь, получение и химические свойства.
Бром и йод. Нахождение в природе. Кислородсодержащие кислоты брома и йода и их соли. Способы получения и свойства. Изменение устойчивости, кислотных и окислительных свойств в ряду кислородных кислот брома и йода.
Применение галогенов и их соединений.
Вопросы и задачи: 12, с. 13, № 1–92.
1. Сколько мл 20%-ной HCl (ρ = 1,1 г/мл) нужно взять для взаимодействия с 10 г КMnO4? Какой объем газа (н.у.) выделится в результате взаимодействия?
(Ответ: V = 84 мл)
2. Используя термодинамические характеристики, сравнить устойчивость газообразных галогеноводородов к термическому разложению на простые вещества.
3. Вычислить константу равновесия системы (СOCl2 = (CO) + + (Cl2), если при некоторой температуре равновесные концентрации оксида углерода и хлора в системе равны и составляют 0,001 моль/л, а С(СOCl2) = 0,002 моль/л. Найти исходную концентрацию СOCl2.
(Ответ: Кс = 5 .10–4; С 0 = 0,03 моль/л)
4. К 1 л раствора с концентрацией НВгО 0,1 моль/л добавили 0,1 моль гипобромита натрия. Как изменится С Н+ и α бромноватистой кислоты?
(Ответ: С Н+ уменьшится от 1,4 .10–5 моль/л до 2,0 .10–9 моль/л, α – от 1,4 до 2,0 .10–8).
5. В 100 мл насыщенного раствора PbI2 содержится 0,0268 г соли в виде ионов. Вычислить D G 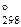 процесса растворения иодида свинца.
процесса растворения иодида свинца.
(Ответ: D G 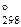 = 51,88 кДж)
= 51,88 кДж)
6. Какая из солей в растворе в большей степени подвергается гидролизу при одинаковых условиях (C, T): а) KClO; б) KClO2; в) KClO3? Ответ подтвердить расчетами.
7. Выпадет ли осадок AgBr при сливании одинаковых объемов 0,1 М раствора бромида калия и 0,2 М раствора Na3[Ag(S2O3)2], содержащего 0,1 моль тиосульфата натрия в 1 л раствора?
(Ответ: нет, ПС = 5 . 10–14)
8. Составить молекулярно-ионные уравнения реакций. Для а) рассчитать константу равновесия (Т = 298 К):
а) KMnO4 + KBr + H2SO4→; б) PbO2 + HCl→.
(Ответ: Кс = 1,54 . 1071)
9. Составить схему и рассчитать ЭДС гальванического элемента, состоящего из серебряного электрода, опущенного в насыщенный раствор AgCl, и водородного электрода, опущенного в 0,01 М раствор гипохлорита натрия. (Т = 298 К).
(Ответ: D Е = 1,1 В)
10. Какие процессы происходят на катоде и аноде при электролизе: 1) расплава NаСl, 2) раствора NаС1?
Литература: 1, с. 309–337; 2, с. 457–471.
Date: 2015-09-24; view: 808; Нарушение авторских прав