
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Свойства водорода
|
|
Водород. Особое положение водорода в периодической системе. Нахождение водорода в природе. Строение молекулы водорода и молекулярного иона Н 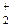 в рамках методов ВС и МО.
в рамках методов ВС и МО.
Промышленные и лабораторные способы получения водорода.
Химические свойства водорода: отношение к кислороду, металлам, неметаллам, оксидам. Окислительные и восстановительные свойства водорода.
Гидриды, способы получения, свойства. Классификация гидридов по типу химической связи – ионные и ковалентные гидриды. Гидролиз гидридов. Объяснение восстановительных свойств иона Н–. Металлические гидриды. Характер связи в гидридах d- и f-элементов. Получение металлических гидридов.
Характеристика водородных соединений неметаллов. Водородная связь на примере соединений HF, NH3, H2O.
Вопросы и задачи:
1. При растворении в 1 л воды 450 л НСl (н.у.) получили раствор с r = 1,21 г/см3. Вычислить молярную концентрацию и массовую долю HCl в растворе.
(Ответ: С = 14 моль/л; ω = 42,3%)
2. Сравнить ∆ G 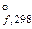 образования водородных соединений ЭН4 элементов IV группы (Э – C, Si, Ge, Sn). Какое из этих соединений устойчивее при 298 К?
образования водородных соединений ЭН4 элементов IV группы (Э – C, Si, Ge, Sn). Какое из этих соединений устойчивее при 298 К?
3. Константа равновесия процесса (H2) + (Br2) ↔ 2 (HBr) составляет при некоторой температуре 0,5. Определить выход HBr в % по объему, если исходные вещества были взяты в количествах 5 моль/л и 3 моль/л соответственно.
(Ответ: η = 33,3%)
4. Найти концентрацию ионов водорода и рН раствора, в котором массовая доля НС1 составляет 0,01%. Какая масса Н+ содержится в 5 л такого раствора?
(Ответ: С = 0,027 моль/л; рН = 2,56; m = 0,0137 г)
5. Какова должна быть минимальная концентрация HI, чтобы прибавление к его раствору равного объема 0,002 н. раствора AgNO3 вызвало появление осадка AgI?
(Ответ: С = 3.10-13 моль/л)
6. Вычислить степень гидролиза, константу гидролиза и рН 0,02 М раствора формиата натрия.
(Ответ: β = 5,3 .10-5; Кг = 5,65 .10-11; рН = 8,03)
7. Определить концентрацию ионов водорода в 0,01 М растворе H2[SiF6].
(Ответ: С = 0,02 моль/л)
8. Закончить уравнения реакций. Для а) определить D G 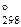 реакции:
реакции:
KMnO4 + K2PbO2 + KOH; б) HIO3 + H2O2.
(Ответ: D G 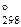 = –69,48 кДж)
= –69,48 кДж)
9. Составить схему и рассчитать ЭДС гальванического элемента, состоящего из стандартных водородного и цинкового электродов. Написать уравнения электродных процессов.
(Ответ: D Е = 0,76 В)
10. Определить напряжение разложения 1н. раствора H2SO4 на электродах из гладкой платины (Т = 298 К).
(Ответ: Uразл. = 2,03 В)
Литература: 1, с. 299–309; 2, с. 452–457.
Date: 2015-09-24; view: 730; Нарушение авторских прав