
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Свойства р-элементов IV группы
|
|
Электронные конфигурации элементов. Характерные степени окисления. Сопоставление устойчивости высших и низших степеней окисления в ряду углерод–свинец. Характер изменения величин радиусов атомов, энергии ионизации. Способность к образованию гомоцепей. Общая характеристика свойств гидридов типа ЭН4, кислотно-основных свойств оксидов и гидратов оксидов со степенью окисления +2, +4.
Углерод, нахождение в природе. Аллотропные модификации углерода: алмаз, графит, карбин, фуллерен, их строение, тип гибридизации. Химические свойства углерода.
Карбиды. Классификация карбидов по типу химической связи. Гидролиз карбидов. Получение и применение карбидов. Карборунд.
Углеводороды. Тип гибридизации атома углерода в метане, этилене, ацетилене. Оксид углерода (II). Получение. Строение молекулы СО с позиций метода ВС и МО. Объяснение сходства физических свойств оксида углерода (II) и азота. Взаимодействие СО с хлором, аммиаком, щелочами. Восстановительные свойства СО. Молекула СО в качестве лиганда в комплексных соединениях. Карбонилы металлов. Оксид углерода (IV). Строение молекулы, получение СО2. Взаимодействие его с водой, аммиаком, растворами щелочей. Карбамид. Угольная кислота и ее соли. Строение иона СО32–. Карбонаты, гидрокарбонаты, термическая устойчивость, гидролиз.
Цианид водорода, получение. Синильная кислота. Комплексные соединения, содержащие цианид-ион.
Соединения углерода с галогенами. Термическая устойчивость и гидролиз.
Кремний, нахождение в природе, получение, отношение к кислороду, галогенам, металлам, кислотам и щелочам. Соединения с водородом, получение, свойства. Галогениды кремния, получение, гидролиз. Гексафторокремниевая кислота.
Оксид кремния (IV). Кремнекислородный тетраэдр как основа кислородных соединений кремния. Химические свойства SiO2. Кислоты кремния, структура и свойства. Соли – орто-, мета- и полисиликаты. Реакции, лежащие в основе получения стекла. Жидкое стекло.
Германий, олово, свинец. Общая характеристика элементов, химические свойства, отношение к кислотам и щелочам. Оксиды элементов (II) и (IV), гидроксиды (II) и (IV), их получение и свойства. Сопоставление устойчивости, кислотно-основных свойств и окислительно-восстановительных свойств оксидов и гидратов оксидов со степенью окисления +2, +4. Станниты, станнаты, плюмбиты и плюмбаты. Сурик, окислительные свойства.
Вопросы и задачи:12, с. 8, № 1–149.
1. К 500 мл 18%-ного рaствора K2CO3 (r=1,19 г/см3) прилили 200 мл воды. Определить молярную концентрацию полученного раствора. (Ответ: С = 1,11 моль/л)
2. Вычислить D G 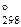 процессов разложения карбонатов s-элементов II группы. На основании полученных величин расположить карбонаты в ряд по их устойчивости.
процессов разложения карбонатов s-элементов II группы. На основании полученных величин расположить карбонаты в ряд по их устойчивости.
3. При нагревании смеси при некоторой температуре установилось равновесие: (СО2) + (Н2) ↔ (СО) + (Н2О). Константа равновесия равна 2. В каких объемных отношениях были взяты СО2 и Н2, если к моменту равновесия прореагировало 40% СО2?
(Ответ: V (CO2): V (H2) = 15: 8)
4. При какой молярной концентрации уксусной кислоты в растворе степень диссоциации равна 0,01? При какой концентрации αувеличится в два раза?
(Ответ: С 1 = 0,18 моль/л; С 2 = 0,045 моль/л)
5. Во сколько раз уменьшится растворимость карбоната стронция в результате добавления к 1 л его насыщенного раствора 0,2 моль карбоната натрия? (Ответ: в 5 . 103 раз)
6. Оценить значение рН (<7 или >7) в 0,1 н. растворе гидрокарбоната натрия.
(Ответ: рН >7)
7. При какой концентрации карбонат-ионов начнется выпадение осадка карбоната цинка из 0,1 М раствора [Zn(NH3)4]SO4, содержащего 1 моль аммиака в 1,5 л раствора?
(Ответ: С = 0,347 моль/л)
8. Закончить уравнения реакций. Для б) определить D G 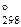 реакции: а) KMnO4 + PbO + KOH→; б) PbO2 + CrCI3 + H2SO4→. (Ответ: D G
реакции: а) KMnO4 + PbO + KOH→; б) PbO2 + CrCI3 + H2SO4→. (Ответ: D G 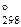 = –202,65 кДж)
= –202,65 кДж)
9. Составить схему и рассчитать ЭДС гальванического элемента, состоящего из свинцового электрода, опущенного в насыщенный раствор PbS, и водородного электрода, опущенного в 0,1 М раствора синильной кислоты (Т = 298 К). (Ответ: D Е = 0,25 В)
10.Определить интервал напряжений, при которых из 1М раствора нитрата олова (II) (рН=1) можно выделить на черненой платине водород без выделения металлического олова (Т = 298 К). (Ответ: U = 1,56 – 1,67 В)
Литература: 1, с. 421–470; 2, с. 361–395.
Date: 2015-09-24; view: 562; Нарушение авторских прав