
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

ЭЛЕКТРОЛИЗ. Цель работы: опытным путем изучить электролиз растворов солей
|
|
Цель работы: опытным путем изучить электролиз растворов солей.
Теоретическая часть
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах, при прохождении электрического тока через раствор или расплав электролита. Это не самопроизвольный процесс, для осуществления химической реакции требуется электрическая энергия. Сущность электролиза заключается в том, что на катоде происходит процесс восстановления, а на аноде – процесс окисления. Процессы, протекающие на электродах, зависят как от электролита, так и от вещества, из которого сделан анод.
Различают два вида анодов: растворимые и нерастворимые.
Нерастворимый, или инертный анод не изменяется в процессе электролиза, играет роль передатчика электронов (графит, уголь, платина и др.).
Растворимый, или активный анод в процессе электролиза окисляется (медь, железо, кобальт и др.): Мео – nē =Мen+.
На электродах легче всего протекают процессы, требующие минимальной затраты энергии. На катоде быстрее восстанавливаются ионы, молекулы, атомы, имеющие наибольшее значение электродного потенциала.
Практическая последовательность восстановления на катоде при электролизе водных растворов:
1) ионы металлов от конца ряда напряжений до цинка: Аu3+....Zn2+ по уравнению:
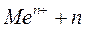 ē
ē 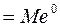 .
.
Металл при этом выделяется в свободном виде.
2) молекулы воды: 2Н2О + 2ē = Н2↑ + 2ОН-.
Если в растворе одновременно находятся катионы нескольких металлов, то при разных концентрациях их в первую очередь на катоде разряжаются ионы того металла, у которого больше величина электродного потенциала. Например, если в растворе одновременно присутствуют в равных концентрациях различные катионы (Zn2+, Au3+, Cu2+, Fe2+), то, в соответствии с величинами их электродных потенциалов, катионы будут восстанавливаться в следующей последовательности: Au3+, Cu2+, Fe2+, Zn2+.
На аноде легче всего окисляются ионы, молекулы, атомы, имеющие наименьшее значение электродного потенциала.
Практическая последовательность окисления на аноде при электролизе водных растворов:
а) анод – инертный:
1) анионы бескислородных кислот: Se2-, S2-, I-, Вr-, Сl- (кроме F-) до соответствующих соединений в свободном виде Se, S, I2, Br2, Cl2↑;
2) молекулы воды: 2Н2О – 4ē = О2↑ + 4Н+;
б) анод — активный:
окисляется сам анод: Мео – nē = Мen+.
Date: 2015-09-24; view: 878; Нарушение авторских прав