
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. Цель работы: проведение ряда окислительно-восстановительных реакций, составление их уравнений методом электронно-ионного баланса и определение типа реакции
|
|
Цель работы: проведение ряда окислительно-восстановительных реакций, составление их уравнений методом электронно-ионного баланса и определение типа реакции.
Теоретическая часть
Окислительно-восстановительными называются реакции, сопровождающие переходом электронов от одних атомов и ионов к другим, в результате чего меняется степень окисления элементов. При этом элемент, отдающий электроны, называется восстановителем, а элемент, который принимает электроны ─ окислителем.
Степенью окисления называется заряд атома, вычисленный исходя из условного предположения, что все связи в молекуле окислителя и восстановителя являются ионными.
При определении степени окисления атомов в соединениях можно руководствоваться следующими положениями:
1. Степень окисления атомов в простых веществах (например, I2, O2, S, Al, Zn и т. п.) принимается равной нулю.
2. Водород в подавляющем большинстве соединений (за исключением гидридов металлов КН, NaH, CaH2 и т. д.) проявляет степень окисления +1.
3. Кислород во всех соединениях, за исключением пероксидов, супероксидов и фторида кислорода обладает степенью окисления ─ 2.
4. Постоянную степень окисления в соединениях имеют щелочные металлы (Li, Nа, К, Cs, Fr) +1 и щелочноземельные металлы (Be, Mg, Ca, Sr, Ba, Ra) +2.
5. Алгебраическая сумма всех зарядов на атомах (или алгебраическая сумма произведений числа атомов на их степень окисления), входящих в состав молекулы, равна 0.
Для уравнивания окислительно-восстановительных реакций коэффициенты не подбираются, как в случае реакций ионного обмена, а вычисляются на основании уравнений электронного или электронно-ионного баланса. Проиллюстрируем оба метода на примере реакции, протекающей по схеме:
NaCrO2 + Br2 + NaOH ® Na2CrO4 + NaBr + H2O.
По методу электронного баланса вначале определяют степени окисления элементов в исходных веществах и продуктах и находят элементы, изменяющие свою степень окисления:
Na+1 Cr +3O2-2 + Br 20 + Na+1O-2H+1 ® Na2+1 Cr +6O4-2 + Na+1 Br -1 + H2+1O-2,
затем для этих элементов составляют уравнения электронного баланса:
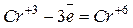 | 2 восстановитель;
| 2 восстановитель;
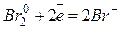 | 3 окислитель.
| 3 окислитель.
Коэффициенты 2 и 3 получены исходя из непременного условия, что количество электронов, принимаемых окислителем, должно быть равно количеству электронов, отдаваемых восстановителем. Выставив найденные коэффициенты перед окислителем и восстановителем, затем уравнивают реакцию в целом:
2 NaCrO2 + 3 Br2 + 8 NaOH = 2 Na2CrO4 + 6 NaBr + 4 H2O.
По методу электронно-ионного баланса уравнения электронного баланса составляют не для элементов, а для ионов или молекул, в состав которых в водных растворах входят элементы, изменяющие свою степень окисления. Для уравнивания используют находящиеся в растворе молекулы воды и ионы, определяющие характер среды (в данном случае ионы ОН-):
 | 2 восстановитель;
| 2 восстановитель;

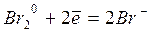 | 3 окислитель.
| 3 окислитель.
Коэффициенты перед окислителем и восстановителем определяются аналогично методу электронного баланса. Преимуществом метода электронно-ионного баланса является то, что одновременно определяются и коэффициенты перед моекулами воды и молекулами, определяющими характер среды (в данном случае NaОН):
2 NaCrO2 + 3 Br2 + 8 NaOH ® 2 Na2CrO4 + 6 NaBr + 4 H2O
Классификация ОВР:
а) межмолекулярные реакции, в которых окислитель и восстановитель – разные вещества:
P 0 + H N +5O3 + H2O ® H3 P +5O4 + N +2O;
б) внутримолекулярные реакции, в которых окислитель и восстановитель в виде атомов разных элементов находятся в составе одной и той же молекулы:
K N +5 O 3-2 ® K N +3O2 + O 20;
в) реакции диспропорционирования (самоокисления ─ самовосстановления), при которых происходит окисление и восстановление атомов одного и того же элемента в одной и той же степени окисления:
K Cl +5O3 ® K Cl-1 + K Cl+7 O4;
г) реакции обратного диспропорционирования, где окислитель и восстановитель – атомы одного и того же элемента в разных степенях окисления:
H2 S -2 + S +4O2 ® S 0 + H2O.
Определение продуктов окислительно-восстановительной реакции является непростой задачей, поскольку их состав зависит от концентрации реагирующих веществ, от кислотности среды и т. д. Так, например, Мn+7 в кислой среде восстанавливается до Мn+2, в нейтральной ─ до Мn+4 и в щелочной – до Мn+6.
Следует также учитывать, что чем более сильный восстановитель участвует в реакции, тем более глубоко восстанавливается окислитель и наоборот. Так, при реакции разбавленной азотной кислоты с малоактивными металлами (Bi, Сu, Ag) oбpaзyeтcя NO, а при реакции ee с активными металлами (Zn, Mg, Ca) ─ N2O, N2 или NH3.
Надо также иметь в виду, что ряд элементов может проявлять целый набор различных степеней окисления. В таблице приведены возможные степени окисления для наиболее распространенных окислителей и восстановителей, соответствующие данным степеням окисления соединения.
Только окислительные свойства проявляют элементы, имеющие высшую степень окисления, только восстановительные ─ элементы в низшей степени окисления и свободные металлы. Элементы, имеющие промежуточную степень окисления, а также свободные неметаллы за исключением F2 могут проявлять как окислительные, так и восстановительные свойства.
Практическая часть
Date: 2015-09-24; view: 575; Нарушение авторских прав