
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гальванические элементы
|
|
Цель работы: опытным путем исследовать активность металлов и изучить анодный и катодный процессы, протекающие в гальваническом элементе.
Теоретическая часть
Количественной характеристикой активности (способности отдавать электроны) являются значения потенциала ионизации и стандартного электродного потенциала. Электродный потенциал – это скачок потенциала, возникающий на границе металл/раствор электролита.
Стандартный электродный потенциал – это не абсолютное значение потенциала, а значение его относительно потенциала нормального водородного электрода, условно принятого за нуль, если концентрации всех участвующих веществ равны 1 моль/л.
Если расположить металлы в ряд в порядке возрастания их стандартных потенциалов, то получим ряд напряжений металлов (см. табл.8.1).
Таблица 8.1. Стандартные потенциалы металлов. Ряд напряжений
| Электрод | Потенциал, В | Электрод | Потенциал, В |
| Li/Li+ | –3,045 | Co/Co2+ | –0,277 |
| К/К+ | –2,924 | Ni/Ni2+ | –0,250 |
| Са/Са2+ | –2,866 | Sn/Sn2+ | –0,136 |
| Na/Na+ | –2,714 | Pb/Pb2+ | –0,126 |
| Mg/Mg2+ | –2,363 | Fe/Fe3+ | –0,037 |
| Al/Al3+ | –1,663 | H2/2H+ | |
| Ti/Ti2+ | –1,630 | Bi/Bi3+ | 0,215 |
| Mn/Mn2+ | –1,179 | Cu/Cu2+ | 0,337 |
| Zn/Zn2+ | –0,763 | Ag/Ag+ | 0,799 |
| Cr/Cr2+ | –0,744 | Hg/Hg2+ | 0,850 |
| Fe/Fe2+ | –0,440 | Pt/Pt2+ | 1,188 |
| Cd/Cd2+ | –0,403 | Au/Au3+ | 1,498 |
Ряд напряжений выражает следующие закономерности:
1. Металлы, расположенные до магния, вытесняют водород из воды.
2. Металлы, стоящие в ряду напряжений до водорода, вытесняют водород из: растворов кислот (соляной, разбавленной серной и др., кроме азотной).
3. Каждый металл вытесняет расположенные после негометаллы из растворов их солей (это условие выполняется для металлов, расположенных после магния).
Если концентрации электролитов не равны 1 моль/л, то электродный потенциал рассчитывается по уравнению Нернста:
 ,
,
где Е° ─ стандартный электродный потенциал,
n ─ заряд иона металла;
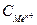 ─ молярная концентрация ионов металла в растворе, моль/л или моль ионов/л.
─ молярная концентрация ионов металла в растворе, моль/л или моль ионов/л.
Date: 2015-09-24; view: 452; Нарушение авторских прав