
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Электролитическая диссоциация. Реакции ионного обмена. Цель работы: изучить условия протекания реакций ионного обмена и правил написания ионообменных реакций в молекулярной и ионно-молекулярной формах
|
|
Цель работы: изучить условия протекания реакций ионного обмена и правил написания ионообменных реакций в молекулярной и ионно-молекулярной формах.
Теоретическая часть
Электролитической диссоциацией называется частичный или полный распад молекул электролита на ионы под действием полярных молекул растворителей. Диссоциация протекает в результате сложного физико-химического взаимодействия молекул электролита с полярными молекулами растворителей. Взаимодействие ионов с полярными молекулами растворителя называется сольватацией (для водных растворов – гидратацией) ионов. В растворах электролитов образуются сольватированные ионы.
Электролиты проводят электрический ток, так как в растворах имеются заряженные частицы: катионы и анионы.
Количественно процесс диссоциации характеризуется степенью электролитической диссоциации α. Степенью диссоциации называется отношение числа молекул, распавшихся на ионы n к общему числу молекул N растворенного вещества:

Степень диссоциации выражается в процентах или долях единицы. Электролиты делятся на три группы: а) сильные (α > 30 %); б) средние (3 < α < 30 %); в) слабые
(α < 3 %).
В учебной литературе приведены таблицы степеней диссоциации кислот, основании и солей. Степень диссоциации зависит от природы растворенного вещества и растворители, температуры, концентрации и присутствия в растворе одноименных ионов. Для слабых электролитов степень диссоциации существенно зависит от концентрации: чем меньше концентрация раствора, тем больше степень электролитической диссоциации.
Значительно удобней характеризовать способность электролитов к диссоциации в растворе константой диссоциации К, которая не зависит от концентрации раствора. Константа диссоциации К представляет собой константу равновесия обратимого процесса диссоциации слабого электролита – кислоты или основания. Константа диссоциации кислот называют также константой кислотности, а оснований – константой основности. Значения констант диссоциации слабых электролитов приведены в таблицах для стандартных условий.
Пример
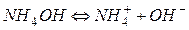 .
.
Константа диссоциации (основности) выражается отношением произведения равновесных концентраций ионов в растворе данного слабого электролита к концентрации недиссоциированных молекул:
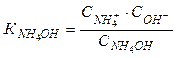 .
.
Константа диссоциации является мерой относительной силы слабых электролитов: чем она меньше, тем слабее электролит. Связь между константой и степенью диссоциации слабого бинарного электролита подчиняется закону разведения Оствальда:
 .
.
Кислотами с точки зрения электролитической диссоциации называются электролиты, образующие в водных растворах положительно заряженные ноны водорода и анионы кислотного остатка. Ионы водорода являются характерными для кислот и определяют их свойства. Кислоты, являющиеся сильными электролитами: азотная HNО3, соляная НСl, бромоводородная НВr, иодоводородная HI, серная H2SO4, марганцовая НМnО4 и другие.
Слабых электролитов значительно больше, чем сильных. Слабыми электролитами являются кислоты: сернистая H2SO3, фтороводородная HF, угольная H2СO3, сероводородная H2S, уксусная CH3COOН и др. Многоосновные кислоты диссоциируют ступенчато. Примеры диссоциации кислот:
HCl = H+ + Cl ‑
CH3COOH 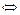 CH3COO‑ + H+
CH3COO‑ + H+
I ступень: H2SO3 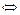 H++ HSО3‑ или H2SO3
H++ HSО3‑ или H2SO3 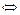 2H++ SО32-,
2H++ SО32-,
II ступень: HSО3‑ 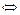 H+ + SО32 ‑
H+ + SО32 ‑
С точки зрения электролитической диссоциации основаниями называются электролиты, образующие в водных растворах отрицательно заряженные гидроксид-ионы ОН‑ и катионы металлов. Гидроксид-ионы обуславливают общие свойства оснований.
Основания с валентностью катиона больше единицы диссоциируют ступенчато. Сильными электролитами являются основания, в которых катионами являются щелочные и щелочноземельные металлы, за исключением Вe(ОН)2 и Mg(OH)2.
Основания преимущественно являются слабыми электролитами, особенно образованные амфотерными металлами. Амфотерные гидроксиды вкислой среде диссоциируют как основания, в щелочной ─ как кислоты. Примеры диссоциации оснований и амфотерных гидроксидов:
NaOH = Na+ + OH-;
I ст. Fe(OH)2 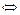 FeOH++OH-
FeOH++OH-
II ст. FeOH+ 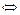 Fe2+ + OH- или Fe(OH)2
Fe2+ + OH- или Fe(OH)2 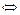 Fe2+ + 2OH-;
Fe2+ + 2OH-;
Zn2+ + 2OH- 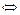 Zn(OH)2
Zn(OH)2 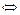 H2ZnО2
H2ZnО2 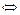 2H+ + ZnO22-.
2H+ + ZnO22-.
Солями называются электролиты, диссоциирующие в воде на положительные ионы металла и отрицательные ионы кислотного остатка. Все соли, хорошо растворимые в воде, являются сильными электролитами. Примеры диссоциации нормальных (средних), кислых, основных, комплексных и двойных солей:
КВr = К+ + Вr-; K3[Fe(CN)6]=3K++[Fe(CN)6]3-;
NaHCO3 = Na+ + HCO3-; KAl(SO4)2 = K+ + Al3+ + 2SO42-.
АlOHCl2 =АlOН2++2С1-;
Изучение различных реакций, в основном в неводных средах, привело к созданию более общих представлений о кислотах и основаниях. К важнейшим из современных теорий кислот и оснований принадлежит протонная теория, согласно которой кислотой является донор протона, то есть частица (молекула или ион), которая способна отдавать ион водорода ─ протон, а основанием ─ акцептор протона, т. е. частица (молекула или ион), способная присоединять протон. Например, в реакции:
HC1+NH3 = NH4+ + Cl-
ион С1- ─ основание, сопряженное кислоте НCl, а ион NH4+ ─ кислота, сопряженная основанию NH3.
Реакции в растворах электролитов протекают между ионами, на которые распадаются молекулы растворенных веществ. Реакции записывают в трех формах: молекулярной, полной ионно-молекулярной и сокращенной ионно-молекулярной. Сильные электролиты записываются в виде ионов, средние и слабые электролиты, осадки и газы – в виде молекул. Сущность реакции отражается сокращенным ионно-молекулярным уравнением, в котором указываются только частицы, которые непосредственно вступают в реакцию и не указываются ионы и молекулы, концентрация которых существенно не изменяется. Реакции между электролитами протекают в сторону образования газа, осадка или более слабого электролита.
Пример реакции в растворах электролитов: нейтрализация слабым основанием (гидроксидом аммония) сильной азотной кислоты. Молекулярное уравнение реакции:
HNO3 + NH4OH = NH4NO3 + Н2О.
В этой реакции сильные электролиты ─ азотная кислота и образующаяся соль – нитрат аммония, которые записывают в виде ионов, а слабые ─ гидроксид аммония и вода, которые записывают в виде молекул. Полное ионно-молекулярное уравнение имеет вид:
Н+ + NО3- + NH4OH = NH4+ + NO3- + Н2О.
Как видно, не претерпевают изменений в ходе реакции только ионы NО3-, исключая их, записывается сокращенное ионно-молекулярное уравнение:
H+ + NH4OH = NH4+ + H2O.
Практическая часть
Date: 2015-09-24; view: 848; Нарушение авторских прав