
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Способы выражения концентраций. 1. Молярность СМ─ это число молей растворенного вещества в 1 л раствора:
|
|
1. Молярность С М ─ это число молей растворенного вещества в 1 л раствора:
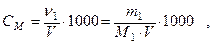
где ν ─ количество молей растворенного вещества;
m1 ─ масса растворенного вещества, г;
М1 ─ молярная масса растворенного вещества, г/моль;
V ─ объем раствора, мл.
2. Нормальность С н (или N) ─ число молей эквивалентов растворенного вещества в 1 л раствора:
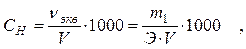
где ν экв ─ количество молей эквивалентов растворенного вещества;
Э ─ эквивалентная масса растворенного вещества, г/моль.
Согласно закону эквивалентов равные объемы одинаковой концентрации содержат одинаковое число молей эквивалентов растворенного вещества, поэтому при одинаковой нормальности объемы растворов реагирующих веществ равны. Если же эти нормальности неодинаковы, то объемы растворов обратно пропорциональны их нормальностям:
 .
.
Основанный на этом метод определения концентрации растворов называется объемным анализом и сводится к измерению объемов растворов реагирующих веществ, концентрация одного из которых известна. Такое измерение производится постепенным прибавлением одного раствора к другому, до окончания реакции, которое определяется с помощью индикатора. Этот процесс называется титрованием.
3. Моляльность Ст ─число молей растворенного вещества в 1000 г растворителя:
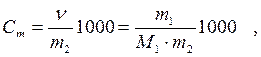
где m1 ─ масса растворенного вещества, г;
m2 ─ масса растворителя, г.
4. Мольная доля χ1 ─отношение числа молей растворенного вещества к сумме числа молей всех компонентов раствора:
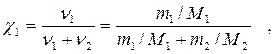
где ν1, ν2 ─ число молей растворенного вещества и растворителя;
М2 ─ молярная масса растворителя,г/моль.
5. Титр Т ─ количество граммов растворенного вещества в 1 см3 раствора:
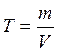 .
.
6. Процентная концентрация или массовая доля ω ─ количество граммов растворенного вещества в 100 г раствора:

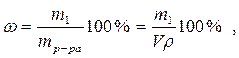
где ρ ─ плотность раствора, г/см3.
Приготовление растворов необходимой концентрации часто производится путем разбавления концентрированных растворов. Нужные весовые количества исходных жидкостей легко находятся при помощи так называемого «правила креста». Так, например, используемая в качестве электролита для аккумуляторов 25%-ная серная кислота готовится из концентрированной 96%-ной кислоты и воды 0%:
 96 25 25 ─ 0 = 25
96 25 25 ─ 0 = 25

 25
25
0 71 96 ─ 25 = 71
В соответствии со схемой для приготовления 25%-ной серной кислоты нужно взять 25 весовых частей 96%-ной серной кислоты и 71 весовую часть воды.
Практическая часть
0пыт № 1. Определение концентрации раствора кислоты
Date: 2015-09-24; view: 594; Нарушение авторских прав