
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Спираль
|
|
Спираль определяется пространственным расположением следующих атомов аминокислот:
1) атомом углерода карбонильной группы;
2) α-углеродным атомом;
3) атомом азота α-аминогруппы.
Наиболее устойчивой из различных типов спиралей является правовращающая α-спираль, которая была впервые предложена в 1950 году Полингом и Кори на основании теоретических расчетов.
α-Спираль может образоваться как из L-аминокислот, так и из
D-кислот, но все аминокислоты спирали должны быть одного стереохимического ряда. Если исходить из L-природных аминокислот, то можно построить как правую, так и левую спираль, однако правая спираль, как показали Полинг и Кори, более стабильна. Во всех изученных природных белках α-спираль, состоящая из L-аминокислот, относится к правому типу.
В данном типе структуры пептидный остов закручивается в виде спирали за счет образования водородных связей между атомами кислорода карбонильных групп и атомами водорода аминогрупп, входящих в состав пептидных связей через четыре аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали. На один виток α-спирали приходится 3,6 аминокислотных остатка. В образовании водородных связей участвуют практически все атомы кислорода и атомы водорода пептидных групп. В результате
α-спираль стягивается множеством водородных связей. Несмотря на то, что водородные связи относят к числу слабых связей, их количество обеспечивает максимально возможную стабильность
α-спирали. Так как все карбонильные группы пептидного остова обычно участвуют в образовании водородных связей, гидро-фильность (т.е. способность образовывать водородные связи с водой) α-спирали уменьшается, а её гидрофобность растет.
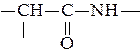 В результате образования α-спирали полипептидная цепь укорачивается, но если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится. Поскольку α-спираль образована только из одного вида повторяющихся звеньев
В результате образования α-спирали полипептидная цепь укорачивается, но если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится. Поскольку α-спираль образована только из одного вида повторяющихся звеньев
, её размеры довольно постоянны.
Радикалы аминокислот находятся на наружной стороне
α-спирали и направлены от пептидного остова в стороны. Они не участвуют в образовании водородных связей, но некоторые из них могут нарушать образование α-спирали. К ним относятся:
1) Пролин.
Его атом азота входит в состав жесткого кольца, что исключает возможность вращения вокруг связи N - СН. Кроме того, у атома азота пролина, образующего пептидную связь с другой аминокислотой, нет атома водорода. В результате пролин не способен образовывать водородную связь и α-спиральная структура нарушается. Обычно в этом месте пептидной цепи возникает петля или изгиб.
Date: 2015-09-25; view: 766; Нарушение авторских прав