
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Определение структуры пептидов
|
|
Для того чтобы выяснить структуру пептида, необходимо знать следующее:
а) какие аминокислоты входят в состав полипептида;
б) сколько аминокислот каждого вида содержится в пептиде;
в) в какой последовательности эти аминокислоты связаны в цепи.
Для определения состава пептида его подвергают гидролизу в горячей соляной кислоте с С(HCl) = 6 моль/л. Полученную смесь аминокислот анализируют на аминокислотном анализаторе и устанавливают качественный и количественный состав пептида. Зная весовое содержание каждой из полученных аминокислот, можно вычислить количество каждой кислоты и тем самым установить «эмпирическую формулу» пептида, т.е. относительное содержание остатков различных аминокислот в пептиде.
Для вычисления «молекулярной» формулы пептида, то есть для установления действительного числа каждого из остатков в молекуле пептида, необходимо знать его молярную массу, которую определяют различными химическими или физическими методами.
Наиболее трудная задача - установить, в какой последователь-ности аминокислотные остатки связаны в пептид. Для решения этого вопроса используют комбинацию двух методов: определение концевых групп и частичный гидролиз.
Идентификацию аминокислотных остатков на концах пептидной цепи проводят, используя их отличие от всех остальных звеньев и друг от друга: N-концевой остаток содержит свободную амино-группу, а С-концевой остаток содержит свободную карбоксильную группу.
Для идентификации N-концевого остатка используют метод Ф. Сенгера, который основан на реакции свободной аминогруппы пептида с динитрофторбензолом. Реакция протекает по механизму нуклеофильного замещения:
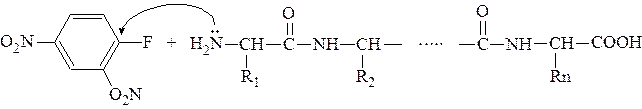
Замещенный пептид подвергают гидролизу, после чего
N-концевой остаток, меченный динитрофенильной группой, выделяют и идентифицируют. N-концевая аминокислота с динитрофторбензолом дает устойчивое, окрашенное в желтый цвет, соединение, которое не разрушается при гидролизе.
Огромный шаг вперед в химии анализа полипептидов был сделан в 1956 году, когда П. Эдман установил, что N-концевую аминокислоту можно удалить при помощи фенилизотиоцианата:
(С6Н5 – N = C = S). В результате следующая за ней аминокислота становится N-концевой и её, в свою очередь, также можно удалить, действуя фенилизотиоцианатом. Этот метод определения N-концевых остатков получил название «метод деградации по Эдману».
Наиболее успешным методом определения С-концевых остатков является не химический метод, а ферментативный. Избирательное удаление С-концевого звена осуществляется при помощи фермента карбоксипептидазы, которая расщепляет лишь ту пептидную связь, которая находится в α-положении к свободной α-карбоксильной группе в полипептидной цепи. Анализ можно повторить на укороченном пептиде, чтобы определить новую С-концевую кислоту.
Однако на практике невозможно определить последовательность остатков аминокислот в длинной пептидной цепи путем ступенчатого удаления концевых остатков. Вместо этого пептид подвергают частичному гидролизу, при котором образуются фрагменты пептидов с укороченной цепью. Эти фрагменты идентифицируют при помощи метода определения концевых групп.
Структура, приписанная пептиду и определенная вышеописан-ным методом, окончательно подтверждается синтезом этого пептида.
Date: 2015-09-25; view: 1028; Нарушение авторских прав