
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Строение полипептидной цепи и пептидной связи
|
|
Мономеры аминокислот, входящие в состав полипептидов, называют аминокислотными остатками. Аминокислотный остаток, имеющий свободную аминогруппу, называют N-концевым и записывают слева пептидной цепи, а имеющий свободную α-карбо-ксильную группу – С-концевым, и записывают справа. Цепь повто-ряющихся атомов –СН – СО – NH– в полипетидной цепи называется пептидным остовом.
Полипептидная цепь имеет следующий общий вид:
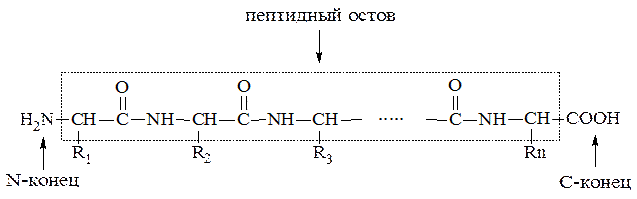
где R1, R2, R3, … Rn – радикалы аминокислот, образующие боковую цепь.
В проявлении биологических функций пептидов и белков большую роль играет электронное и пространственное строение пептидной группы:
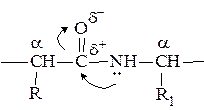
Наличие р-π-сопряжения в пептидной группе приводит к частичной двоесвязанности связи С – N. Длина пептидной связи
С – N равна 0,132 нм, а длина связи N – Сα составляет 0,147 нм. Одинарная связь С – N в пептидах примерно на 40% имеет характер двойной связи, а двойная связь С = О приблизительно на 40% является одинарной. Это обстоятельство приводит к двум важным последствиям:
1) иминогруппа (– NH –) пептидной связи не обладает заметно выраженной способностью отщеплять или присоединять протон;
2) свободное вращение вокруг связи C – N отсутствует.
Частичая двоесвязанность связи С – N означает, что пептидная группа представляет собой плоский участок пептидной цепи. Плоскости пептидных групп расположены под углом друг к другу:
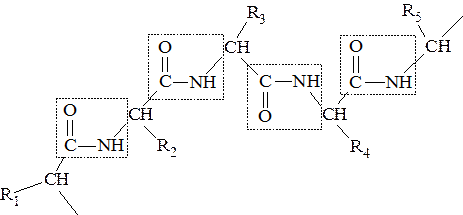
Вокруг связей С – Сα и N – Сα возможно вращение, хотя и ограниченное размерами и характером радикалов, что позволяет полипептидной цепи принимать различные конфигурации.
Пептидная связь является единственной ковалентной связью, при помощи которой аминокислотные остатки соединяются друг с другом, образуя остов белковой молекулы.
Пептидные связи обычно расположены в транс-конфигурации, т.е. α-углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся в пространстве на наиболее удаленном расстоянии друг от друга.
Date: 2015-09-25; view: 969; Нарушение авторских прав