
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Способы записи электронных конфигураций атомов и ионов
|
|
В зависимости от преследуемой цели практикуются различные способы записи электронных конфигураций атомов и ионов.
Электронные оболочки. Наиболее простой способ — запись по электронным оболочкам. При этом указываются заряд ядра и количество электронов на каждой электронной оболочке по мере увеличения ее номера. Например, для атома азота и его иона N+ электронная конфигурация по оболочкам выглядит так:

Как было показано ранее, максимальное число электронов на n-й электронной оболочке равно 2n2. Тода на 1-й оболочке может разместиться максимум 2 электрона, а на второй не более 8. Однако у атома азота всего 7 электронов (общее число электронов в атоме равно заряду ядра), поэтому на 2-й оболочке разместятся остальные 7 — 2 = 5 электронов. В положительно заряженном ионе азота заряд ядра превышает суммарный заряд электронов на +1, поэтому число электронов в данном ионе на 1 меньше, чем в атоме. При этом удаляют электрон с внешней электронной оболочки.
Электронные оболочки и подоболочки. Этот метод записи электронных конфигураций используют наиболее часто. Номер электронной оболочки (главное квантовое число) указывают цифрой, а тип подоболочки (орбитальное квантовое число) — буквой s, р, d или f. Количество электронов указывается цифрой справа вверху у символа подоболочки. Для атома и иона азота данная запись имеет следующий вид:
7N 1s22s22p3 7N+ 1s22s22p2
В соответствии с максимальной возможной заселенностью s-подоболочек, равной 2, первые четыре электрона полностью заполняют 1-ю и 2-ю s-подоболочки. Оставшиеся электроны размещаются на р-подоболочке.
Электронные оболочки, подоболочки и заселенность орбиталей. При
обсуждении валентности атомов и ионов, изучении природы химической связи, исследовании магнитных и других свойств атомов, молекул или их ионов применяют способ записи по электронным оболочкам, подоболочкам с указанием заселенности орбиталей электронами. Опираясь на запись электронных конфигураций по оболочкам и подоболочкам, в данном способе учитывают максимальное количество орбиталей (АО) электронной подоболочки и производят размещение электронов среди них в соответствии с правилом Хунда. Для атома и иона азота такая запись осуществляется следующим образом. Записывается электронная конфигурация по оболочкам и подоболочкам, но не в строку, как прежде, а в столбец. Причем электронные подоболочки записываются снизу вверх по мере увеличения энергии. Затем справа от записанной электронной конфигурации горизонтальными линиями указывают формальное расположение энергетических уровней АО. Уровней указывается столько, сколько АО имеется на данной электронной подоболочке. Наконец, стрелками указываются размещаемые по АО электроны (на основе положений настоящего раздела). Для нашего примера это будет выглядеть так:
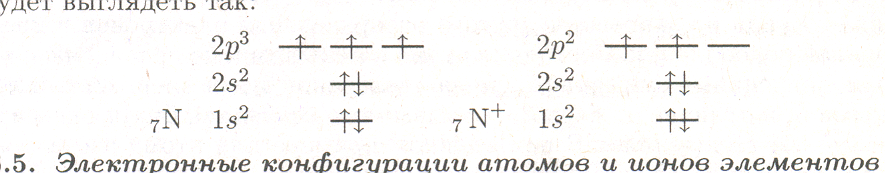
Электронные конфигурации атомов и ионов элементов периодической системы. Первоначально в таблице периодической системы Д. И. Менделеева (1869 г.) элементы были расположены на основании их атомных масс и химических свойств. В действительности оказалось, что решающий фактор при этом — не атомная масса, а заряд ядра и, соответственно, число электронов в нейтральном атоме. Применение трех положений, определяющих распределение электронов в многоэлектронных атомах, позволяет объяснить оболочечную структуру атомов и принципы построения таблицы периодической системы элементов (ПС).
Наиболее устойчивое состояние электрона в атоме соответствует минимальному возможному значению его энергии. Любое другое его состояние является возбужденным, неустойчивым: из него электрон самопроизвольно переходит в состояние с более низкой энергией. Поэтому в невозбужденном атоме водорода (заряд ядра Z = 1) единственный электрон находится в самом низком из возможных энергетических состояний, т. е. на 1s-подуровне. Электронную конфигурацию атома водорода можно записать как 1s1 или представить схемой:
Н 1s1
В атоме гелия (Z = 2) второй электрон также находится в состоянии 1s. Его электронная конфигурация (1s2) изображается схемой:
Не 1s2
У этого элемента заканчивается заполнение ближайшего к ядру K-слоя и тем самым завершается построение первого периода системы элементов.
У следующего за гелием элемента — лития (Z = 3) третий электрон уже не может разместиться на орбитали К-слоя: это противоречило бы принципу Паули. Поэтому он занимает s-состояние второго энергетического уровня конфигурация записывается формулой 1s32s1, что соответствует схеме:
Li
Число и взаимное расположение энергетических подуровней на последней схеме показывает, что: 1) электроны в атоме лития расположены на двух энергетических уровнях, причем первый из них состоит из одного подуровня (1s) и целиком заполнен; 2) второй — внешний — энергетический уровень соответствует более высокой энергии и состоит из двух подуровней (2s и 2р); 3) 2 s- подуровень включает одну орбиталь, на которой в атоме лития находится один электрон; 4) 2р-подуровень включает три энергетически равноценные орбитали, которым соответствует более высокая энергия, чем энергия, отвечающая 2s-орбитали; в невозбужденном атоме лития 2p-орбитали остаются незанятыми.
В дальнейшем на электронных схемах мы для упрощения будем указывать только неполностью занятые энергетические уровни. В соответствии с этим, строение электронной оболочки атома следующего элемента второго периода — бериллия (Z = 4} — выражается схемой:
Ве
или формулой 1s22s2. Таким образом, как и в первом периоде, построение второго периода начинается с элементов, у которых впервые появляются s-электроны нового электронного слоя. Вследствие сходства в структуре внешнего электронного слоя такие элементы проявляют много общего и в своих химических свойствах. Поэтому их принято относить к общему семейству s -элементов.
Элементы, у атомов которых последней заполняющейся электронной подоболочкой является s-подоболочка, называются s-элементами. Так Ве, Мg, Са, Sг, Bа и Rа относятся к s-элементам. Аналогичным образом выделяются p-, d- и f-элементы.
Электронная структура атома следующего за бериллием элемента — бора (Z =5) изобразится схемой:
В
и может быть выражена формулой 1s22s22р1.
При увеличении заряда ядра еще на единицу, т. е. при переходе к углероду (Z = 6), число электронов на 2р-подуровне возрастает до 2: электронное строение атома углерода выражается формулой 1s22s22р2. Однако этой формуле могла бы соответствовать любая из трех схем:
(1)
(2)
(3)
Cогласно схеме (1), оба 2р-электрона в атоме углерода занимают одну и ту же орбиталь, т. е. их магнитные квантовые числа одинаковы, а направления спинов противоположны; схема (2) означает, что 2р-электроны занимают разные орбитали (т. е. обладают различными значениями m) и имеют противоположно направленные спины; наконец, из схемы (3) следует, что двум 2р- электронам соответствуют разные орбитали, а спины этих электронов направлены одинаково. Анализ атомного спектра углерода показывает, что для невозбужденного атома углерода правильна именно последняя схема, соответствующая наибольшему возможному значению суммарного спина атома (для схем атома углерода (1) и (2) эта сумма равна нулю, а для схемы (3) равна единице). Такой порядок размещения электронов в атоме углерода представляет собой новый пример из общей закономерности, выражаемой правилом Хунда. С физической точки зрения такое распределение электронов соответствует удалению друг от друга и понижению энергии их взаимного отталкивания. В результате система переходит в наиболее выгодное энергетическое состояние.
Аналогично получается схема электронного строения для атома следующего элемента — азота (Z = 7):
N
Этой схеме соответствует формула 1s22s22р3.
Теперь, когда каждая из 2р-орбиталей занята одним электроном, начинается попарное размещение электронов на 2р-орбиталях. Атому кислорода (Z = 8) соответствует формула электронного строения 1s22s22р4 и следующая схема:
O
У атома фтора (Z = 9) появляется еще один 2р-электрон. Его электронная структура выражается, следовательно, формулой 1s22s22р5 и схемой:
F
Наконец, у атома неона (Z = 10) заканчивается заполнение 2р-подуровня, а тем самым заполнение второго энергетического уровня (L-слоя) и построение второго периода системы элементов:
Ne
Таким образом, начиная с бора (Z = 5) и заканчивая неоном (Z = 10), происходит заполнение р-подуровня внешнего электронного слоя; элементы этой части второго периода относятся, следовательно, к семейству р-элементов.
Атомы натрия (Z = 11) и магния (Z = 12) подобно первым элементам второго периода — литию и бериллию — содержат во внешнем слое соответственно один и два s-электрона. Их строению отвечают электронные формулы 1s22s22р63s1 (натрий) и 1s22s22р63s2 (магний) и следующие схемы:
Na
Mg
Далее, начиная с алюминия (Z = 13), происходит заполнение подуровня Зр. Оно заканчивается у благородного газа аргона (Z = 18), электронное строение которого выражается схемой:
Ar
и формулой 1s22s22р63s23р6.
Таким образом, третий период, подобно второму, начинается с двух s-элементов, за которыми следует шесть р-элементов. Структура внешней электронной оболочки соответствующих элементов второго и третьего периодов оказывается, следовательно, аналогичной. Так, у атомов лития и натрия на внешней электронной оболочке находится по одному s-электрону, у атомов азота и фосфора — по два s- и по три р-электрона и т. д. Иначе говоря, с увеличением заряда ядра электронная структура внешних электронных оболочек атомов периодически повторяется. Ниже мы увидим, что это справедливо и для элементов последующих периодов. Отсюда следует, что расположение элементов в периодической системе соответствует электронному строению их атомов. Но электронное строение атомов определяется зарядом их ядер и, в свою очередь, определяет свойства элементов и их соединений. В этом и состоит сущность периодической зависимости свойств элементов от заряда ядра их атомов, выражаемой периодическим законом.
Продолжим рассмотрение электронного строения атомов. Мы остановились на атоме аргона, у которого целиком заполнены 3s- и Зр-подуровни, но остаются незанятыми все орбитали Зd-подуровня. Однако у следующих за аргоном элементов — калия (Z = 19) и кальция (Z= 20) —- заполнение третьей электронной оболочки временно прекращается и начинает формироваться s-подуровень четвертой оболочки: электронное строение атома калия выражается формулой 1s22s22р63s23р64s1, атома кальция — 1s22s22р63s23р64s2 и следующими схемами:
K
Ca
Причина такой последовательности заполнения электронных энергетических подуровней заключается в следующем. Как уже указывалось, энергия электрона в многоэлектронном атоме определяется значениями не только главного, но и орбитального квантового числа. Подуровень 4s характеризуется более низкой энергией, чем подуровень Зd, что связано с более сильным экранированием d-электронов в сравнении с s-электронами. В соответствии с этим размещение внешних электронов в атомах калия и кальция на 4s-подуровне соответствует наиболее устойчивому состоянию этих атомов. Электронное строение атомов калия и кальция соответствует правилу Клечковского. Действительно, для Зd-орбиталей (n = 3, l = 2) сумма (n+l) равна 5, а для 4s-орбитали (n = 4, l = 0) — равна 4. Следовательно, 4s-подуровень должен заполняться раньше, чем подуровень Зd, что в действительности и происходит.
Итак, у атома кальция завершается построение 4 s- подуровня. Однако при переходе к следующему элементу — скандию (Z = 21) — возникает вопрос: какой из подуровней с одинаковой суммой (n + l) — 3d (n = 3, l = 2), 4р (n = 4, l = 1) или 5s (п = 5, l = 0) — должен заполняться? В подобных случаях порядок заполнения электронами энергетических подуровней определяется вторым правилом Клечковского, согласно которому при одинаковых значениях суммы (п + I) заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа п. В соответствии с этим правилом в случае (п + 1) = 5 сначала должен заполняться подуровень Зd (п — 3), затем — подуровень 4р (n= 4) и, наконец, подуровень 5s (n = 5). У атома скандия, следовательно, должно начинаться заполнение 3d-орбиталей, так что его электронное строение соответствует формуле 1s22s22р63s23р63d14s2 и схеме;
Sc
В формулах электронных конфигураций принято сначала последовательно записывать все состояния с данным значением n, а затем уже переходить к состояниям с более высоким значением n. Поэтому порядок записи не всегда совпадает с порядком заполнения энергетических подуровней. Так, в записи электронной формулы атома скандия подуровень d помещен раньше подуровня 4s, хотя заполняются эти подуровни в обратной последовательности.
Заполнение Зd-подуровня продолжается и у следующих за скандием элементов — титана, ванадия и т. д. — и полностью заканчивается у цинка (Z = 30), строение атома которого выражается схемой:
Zn
что соответствует формуле 1s22s22р6Зр63d104s2.
Десять d-элементов, начиная со скандия и кончая цинком, принадлежат к переходным элементам. Особенность построения электронных оболочек этих элементов по сравнению с предшествующими (s- и p-элементами) заключается в том, что при переходе к каждому последующему d-элементу новый электрон появляется не на внешней (n — 4), а на второй снаружи (n — 3) электронной оболочке. У атомов всех переходных элементов внешняя электронная оболочка образована двумя s-электронами. Существуют d-элементы (например, хром, молибден, элементы подгруппы меди), у атомов которых во внешнем электронном слое имеется только один s-электрон. Причины этих отклонений от «типичного» порядка заполнения электронных энергетических подуровней рассмотрим позднее. В связи с этим важно отметить, что химические свойства элементов в первую очередь определяются структурой внешней электронной оболочки их атомов и лишь в меньшей степени зависят от строения предшествующих (внутренних) электронных оболочек. Поэтому химические свойства d-элементов с увеличением атомного номера изменяются не так резко, как свойства s- и р-элементов. Все d-элементы принадлежат к металлам, тогда как заполнение внешнего р-подуровня приводит к переходу от металла к типичному неметаллу и, наконец, к благородному газу.
После заполнения Зd-подуровня (n = 3, l = 2) электроны, в соответствии со вторым правилом Клечковского, занимают подуровень 4р (n = 4, l = 1), возобновляя тем самым построение N-слоя. Этот процесс начинается у атома галлия (Z = 31) и заканчивается у атома криптона (Z = 36), электронное строение которого выражается формулой 1s22s22р63s23р63d104s24р6. Как и атомы предшествующих благородных газов — неона и аргона, атом криптона характеризуется структурой внешней электронной оболочки пs2sр6, где n — главное квантовое число (неон — 2s22р6, аргон — Зs23р6, криптон — 4s24р6).
Начиная с рубидия, заполняется 5s- подуровень; это тоже соответствует второму правилу Клечковского. У атома рубидия (Z = 37) появляется характерная для щелочных металлов структура с одним s-электроном во внешнем электрон- ном слое. Тем самым начинается построение нового — пятого — периода системы элементов. При этом, как и при построении четвертого периода, остается незаполненным d-подуровень предвнешней электронной оболочки. Напомним, что на четвертой электронной оболочке имеется уже и f-подоболочка, заполнения которой в пятом периоде тоже не происходит.
У атома стронция (Z = 38) подуровень s5 занят двумя электронами, после чего происходит заполнение 4d-подуровня, так что следующие десять элементов — от иттрия (Z= 39) до кадмия (Z = 48) — принадлежат к переходным d-элементам. Затем от индия до благородного газа ксенона расположены шесть p-элементов, которыми и завершается пятый период. Таким образом, четвертый и пятый периоды по своей структуре оказываются вполне аналогичными.
Шестой период, как и предыдущие, начинается с двух s-элементов (цезий и барий), которыми завершается заполнение орбиталей с суммой (n+l), равной 6. Теперь, в соответствии с правилами Клечковского, должен заполняться подуровень 4f (n= 4, l = 3) с суммой (n + l), равной 7, и с наименьшим возможным при этом значении главного квантового числа. На самом же деле у лантана (Z= 57), расположенного непосредственно после бария, появляется не 4f-, а 5d-электрон, так что его электронная структура соответствует формуле 1s22s22pб3s23р63d104s24p64d105s25р65d1бs2. Однако уже у следующего за лантаном элемента церия (Z= 58), действительно, начинается застройка подуровня 4f, на который переходит и единственный 5d-электрон, имевшийся в атоме лантана; в соответствии с этим электронная структура атома церия выражается формулой 1s22s22p6Зs23p63d104s24p64d104f25s25р66s2. Таким образом, отступление от второго правила Клечковского, имеющее место у лантана, носит временный характер: начиная с церия, происходит последовательное заполнение всех орбиталей 4f-подуровня. Расположенные в этой части шестого периода четырнадцать лантаноидов относятся к f-элементам и близки по свойствам к лантану. Характерной особенностью построения электронных оболочек их атомов является то, что при переходе к последующему f-элементу новый электрон занимает место не во внешнем (n= 6) и не в предшествующем (n = 5), а в еще более глубоко расположенном, третьем снаружи электронном слое (n= 4).
Благодаря отсутствию у атомов лантаноидов существенных различий в структуре внешней и предвнешней электронных оболочек, все лантаноиды проявляют большое сходство в химических свойствах.
Заполнение 5d-подуровня, начатое у лантана, возобновляется у гафния (Z = 72) и заканчивается у ртути (Z = 80). После этого, как и в предыдущих периодах, располагаются шесть р-элементов. Здесь происходит построение 6р-подуровня: оно начинается у таллия (Z= 81) и заканчивается у благородного газа радона (Z= 86), которым и завершается шестой период.
Седьмой, пока незавершенный период системы элементов, построен аналогично шестому. После двух s-элементов (франций и радий) и одного d-элемента (актиний) здесь расположено 14 f-элементов, свойства которых проявляют известную близость к свойствам актиния. Эти элементы, начиная с тория (Z= 90) и кончая элементом 103 — лоуренсием, обычно объединяют под общим названием актиноидов. Непосредственно за актиноидами расположены d-элементы от дубния (Z= 104) до мейтнерия (Z= 109), которые и завершают известную пока часть периодической системы элементов.
Распределение электронов по энергетическим уровням (электронным оболочкам) в атомах всех известных химических элементов приведено в периодической системе элементов, помещенной в приложении.
Следует иметь в виду, что правила Клечковского не отражают частных особенностей электронной структуры атомов некоторых элементов. Например, при переходе от атома никеля (Z = 28) к атому меди (Z = 29) число Зd-электронов увеличивается не на один, а сразу на два за счет «проскока» одного из 4s-электронов на подуровень 3d Таким образом, электронное строение атома меди выражается формулой 1s22s22р63s23рв3d104s1. Аналогичный «проскок» электрона с внешнего s- на d-подуровень предыдущего слоя происходит и в атомах аналогов меди — серебра и золота. Это явление связано с повышенной энергетической устойчивостью электронных структур, отвечающих полностью занятым энергетическим подуровням. Переход электрона в атоме меди с подуровня 4s на подуровень Зd (и аналогичные переходы в атомах серебра и золота) приводит к образованию целиком заполненного d-подуровня и поэтому оказывается энергетически выгодным.
Повышенной энергетической устойчивостью обладают и электронные конфигурации с ровно наполовину заполненным подуровнем (например, структуры, содержащие три р-электрона во внешнем слое, пять d-электронов в предвнешнем слое или семь f -электронов в еще более глубоко расположенном слое). Этим объясняется «проскок» одного 4 s -электрона в атоме хрома (Z = 24) на d -подуровень, в результате которого атом хрома приобретает устойчивую электронную конфигурацию (1s22s22рв3s23p63d54s1) с ровно наполовину заполненным З d -подуровнем; аналогичный переход 5 s -электрона на 4d-подуровень происходит и в атоме молибдена (Z = 42).
Упомянутые выше нарушения «типичного» порядка заполнения энергетических состояний в атомах лантана (появление 5 d -, а не 4 f -электрона) и церия-(появление сразу двух 4 f -электронов) и аналогичные особенности в построении электронных структур атомов элементов седьмого периода объясняются следующим. При увеличении заряда ядра электростатическое притяжение к ядру электрона, находящегося на данном энергетическом подуровне, становится более сильным, и энергия электрона уменьшается. При этом энергия электронов, находящихся на разных подуровнях, изменяется неодинаково, поскольку по отношению к этим электронам заряд ядра экранируется в разной степени. В частности, энергия 4 f -электронов уменьшается с ростом заряда ядра более резко, чем энергия 5 d -электронов.
Поэтому оказывается, что у лантана (Z = 57) энергия 5 d -электронов ниже, а у церия (Z = 58) выше, чем энергия 4 f -электронов. В соответствии с этим, электрон, находившийся у лантана на подуровне 5 d, переходит у церия на подуровень 4 f.
Последовательное заполнение электронами электронных подоболочек показывает, что элементы одних и тех же подгрупп ПС имеют близкие электронные конфигурации внешних электронных подоболочек. Эти конфигурации отличаются, в основном, значением главного квантового числа (номером электронной оболочки). Запишем электронную конфигурацию, обобщающую электронные конфигурации всех атомов из таблицы периодической системы с полностью заполненными (говорят — «закрытыми») электронными подоболочками:
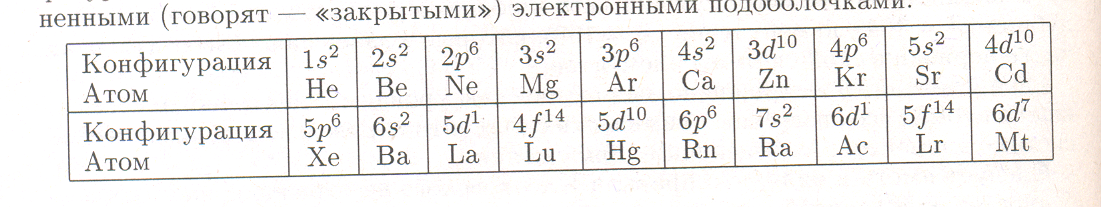
Обобщенная конфигурация записана в порядке заполнения электронных подоболочек электронами в нейтральных атомах. Одновременно приведены и электронные конфигурации трех атомов с незаполненными полностью («открытыми») подоболочками: La, Ас и Mt. Последнее связано с тем, что после Lа и Ас изменяется привычный порядок заполнения электронных подоболочек, а Мt — последний тяжелый известный элемент. Отсюда, например, видно, что элементы Ве, Мg, Са, Sг, Ва и Rа имеют одинаковую электронную конфигурацию пs2 внешних электронных подоболочек. Поэтому они располагаются в одной подгруппе ПС.
Date: 2015-09-18; view: 3212; Нарушение авторских прав