
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Где — Q1, Q2, Q3 – количество теплоты, полученное или отданное телами; n — число тел, участвующих в теплообмене
|
|
Теплоту, полученную телом, считают положительной и в уравнении ставят знак «+»; теплоту, отданную телом, считают отрицательной и ставят знак «-».
Тепловым эффектом химической реакции называют алгебраическую сумму поглощенной при реакции теплоты и совершённой работы за вычетом работы против сил внешнего давления (pΔV).
В соответствии с первым законом термодинамики:
Q = ΔU + A, (3)
где ΔU – изменение внутренней энергии системы; A – совершенная системой работа,
тепловой эффект реакции зависит от пути и способа проведения процесса. Однако, по крайней мере, при соблюдении одного из двух условий теплота химической реакции не зависит от пути и способа осуществления взаимодействия:
1) если реакция протекает в изохорно-изотермических условиях и при этом не совершается работа (А=0; V=const; T=const), то тепловой эффект реакции равен изменению внутренней энергии системы и, следовательно, не зависит от пути процесса:
QV,T = ΔU = U2 – U1, (4)
где U2 – внутренняя энергия продуктов реакции; U1 - внутренняя энергия исходных веществ;
2) если реакция протекает в изобарно-изотермических условиях (P=const; T=const) и при этом не совершается никакой работы, кроме работы расширения, то тепловой эффект реакции равен изменению энтальпии системы и следовательно не зависит от пути процесса:
QP,T = ΔH = H2 – H1, (5)
где Н2 – энтальпия продуктов реакции; Н1 – энтальпия исходных веществ.
Измерение тепловых эффектов реакций составляет обширную область термохимии, данные которой позволяют составить правильное представление об энергетической ценности той или иной реакции, ее внутреннем механизме, возможном направлении кинетики и т. д.
Для практических измерений тепловых эффектов употребляются калориметры.
Результаты опытов по измерению тепловых эффектов очень интересны. Так, оказалось, что 1 г веществ, из которых состоит бактерия (кишечная палочка), выделяет в час около 400 кал (1 кал = 4,1868 Дж), 1 г вещества таракана выделяет 50 кал/ч, 1 г вещества улитки – около 0,5 кал/ч. Особенно поучительно сравнение этих величин с теми, которые характеризуют неживые объекты, 1 г веществ, образующих тело человека, выделяет в 10 000 раз больше теплоты, чем 1 г материи Солнца; летящая муха дрозофила выделяет за единицу времени столько же энергии, сколько автомобиль на полной скорости, а бактерия – столько же, сколько реактивный самолет (конечно, в расчете на равные веса). Эти парадоксальные результаты указывают на исключительную мощность синтетических процессов в живых организмах и необычайные энергетические возможности жизни.
Результаты термохимических измерений – тепловые эффекты реакций – принято относить к одному молю образующегося вещества. Количество теплоты, которое выделяется при образовании 1 моля соединения из простых веществ, называется теплотой образования данного соединения. Например, выражение «теплота образования воды равна 285,8 кДж/моль» означает, что при образовании 18 г жидкой воды из 2 г водорода и 16 г кислорода выделяется 285,8 кДж.
Если элемент может существовать в виде нескольких простых веществ, то при расчете теплоты образования этот элемент берется в виде того простого вещества, которое при данных условиях наиболее устойчиво. Теплоты образования наиболее устойчивых простых веществ принимаются равными нулю. Например, при обычных условиях наиболее устойчивой формой кислорода является молекулярный кислород О2, теплота образования которого считается равной нулю. Теплота же образования озона О3 равна -142 кДж/моль, поскольку при образовании из молекулярного кислорода одного моля озона поглощается 142 кДж.
Тепловые эффекты можно включать в уравнения реакций. Химические уравнения, в которых указано количество выделяющейся или поглощаемой теплоты, называются термохимическими уравнениями. Величина теплового эффекта указывается обычно в правой части уравнения со знаком плюс в случае экзотермической реакции и со знаком минус в случае эндотермической реакции.
Например, термохимическое уравнение реакции образования жидкой воды имеет вид
2H2 + O2 = 2H2O + 571,6 кДж, или
H2 + ½ O2 = H2O + 285,8 кДж
Возможна и другая запись термохимических уравнений, в которой величина теплового эффекта указана в виде изменения энтальпии ∆H. Часто изменение энтальпии записывается как ∆H0298. Верхний индекс 0 означает стандартную величину теплового эффекта реакции, а нижний температуру, при которой идет взаимодействие. В реакциях, идущих с выделением теплоты (экзотермических), энтальпия системы уменьшается (∆H ‹ 0); в реакциях, идущих с поглощением теплоты (эндотермических), энтальпия системы увеличивается (∆H › 0).
Ниже приведен пример записи термохимического уравнения с учетом вышесказанного:
N2 + O2 = 2NO, ∆H0298=+ 90,25 кДж
Данная запись означает, что реакция образования оксида азота (II) идет с поглощением теплоты (эндотермическая).
Обе формы записи правильны и возможно использование любой из них.
Важнейшей характеристикой веществ, применяемых в качестве топлива, является их теплота сгорания. Эту величину также принято относить к одному молю вещества. Таким образом, выражение «теплота сгорания ацетилена равна 1300 кДж/моль» эквивалентно термохимическому уравнению
С2H2 + 2 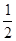 O2 = H2O + 2CO2 + 1300 кДж
O2 = H2O + 2CO2 + 1300 кДж
Величина теплового эффекта зависит от природы исходных веществ и продуктов реакции. Их агрегатного состояния и температуры. Для удобства сравнения различных реакций по величинам их тепловых эффектов последние обычно указывают для случая, когда температура исходных веществ и продуктов реакции равна 250С[1].
[1] Все тепловые эффекты, приводимые в таблицах термодинамических величин, относятся к 250С.
При этом также подразумевается, что участвующие в реакции вещества находятся в том агрегатном состоянии, которое устойчиво при 250С (стандартной температуре). Агрегатное состояние вещества указывается в уравнении реакции: для обозначения кристаллического состояния используется знак (к) около формулы вещества, жидкого – (ж), газообразного – (г).
Изменение давления, концентрации веществ и температуры приводит к смещению равновесия в ту или иную сторону. Направление смещения определяется известным принципом Ле-Шателье: при воздействии на систему, находящуюся в равновесии, равновесие смещается в сторону той из двух противоположных реакций (прямой или обратной), которая ослабляет эффект внешнего воздействия. Остановимся подробнее на влиянии температуры.
Реакция между кислородом и водородом сопровождается выделением тепла (уменьшением энтальпии)
2Н2 + О2 = 2Н2О + Q (DH<0)
Пусть все три вещества при температуре Т1 находятся в равновесии, описываемом константой К1:
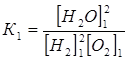 .
.
Затем температура повышается до Т2 и достигнуто новое состояние равновесия с константой К2:
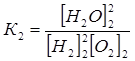 .
.
Спрашивается, как отличаются константы К1 и К2? Из принципа Ле-Шателье следует, что при повышении температуры равновесие смещается в сторону той реакции, которая ослабляет повышение температуры, а такой реакцией является процесс, идущий с поглощением тепла. Для данной системы это будет реакция диссоциации воды:
2Н2О = 2Н2 + О2 – Q.
При повышении температуры равновесие смещается в сторону образования H2 и O2, т.е. с ростом температуры скорость взаимодействия кислорода и водорода замедляется, а скорость диссоциации воды возрастает, и это приводит к росту концентраций О2 и Н2 в равновесной газовой смеси.
В реакции
2Н2 + О2 = 2Н2О + Q
повышение температуры будет уменьшать константу равновесия, следовательно, [Н2О]1 > [ Н2О]2, [H2]1 < [H2]2, [O2]1 < [O2]2.
Отсюда вытекает общее правило: повышение температуры вызывает уменьшение константы равновесия реакции, идущей с выделением тепла (с уменьшением энтальпии) и увеличение константы равновесия реакции, сопровождающейся поглощением тепла (увеличением энтальпии).
Направление смещения химического равновесия и изменение константы (увеличение или уменьшение её) определяется знаком теплового эффекта или знаком изменения энтальпии (табл.1).
Таблица 1.
| Реакция | Тепловой эффект | Изменение энтальпии | Смещение равновесия | Изменение константы равновесия | ||
| Повышение температуры | Понижение температуры | Повышение температуры | Понижение температуры | |||
| эндотермическая | -Q | DH>0 | ® | увеличение | уменьшение | |
| экзотермическая | +Q | DH<0 | ® | уменьшение | увеличение |
Степень смещения равновесия определяется величиной теплового эффекта, или величиной изменения энтальпии. Чем больше эти величины, тем значительнее влияние температуры на константу равновесия.
По степени изменения состояния равновесия при изменении температуры можно судить о тепловом эффекте реакции. Если известны две константы равновесия (К1 и К2) при двух температурах Т1 и Т2, то изменение энтальпии при протекании реакции вычисляют по следующей формуле:
Данное уравнение широко используется в физико-химических расчетах для нахождения тепловых эффектов.
Термохимические законы
Date: 2015-09-18; view: 1588; Нарушение авторских прав