
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическая кинетика и катализ
|
|
Учение о скоростях химических реакций называется химической кинетикой.
Скорость химической реакции характеризует развитие реакции во времени и определяется изменением концентрации любого из реагирующих веществ (или продуктов реакции) в единицу времени. От скорости химической реакции зависит время достижения в системе равновесного состояния. Поскольку количества взаимодействующих исходных веществ и продуктов связаны уравнением химической реакции, то изменения концентраций всех участвующих в реакции веществ пропорциональны друг другу (с учетом стехиометрических коэффициентов в уравнении реакции). Скорость реакции зависит от концентрации реагирующих веществ, температуры, давления, наличия катализатора, воздействия излучений и др. Для биологических систем характерным является протекание реакций с незначительными скоростями (например гидролиз нуклеиновых кислот, полисахаридов, белков).
Скорость реакции, измеренная по изменению концентрации вещества за некоторый промежуток времени, называется средней скоростью (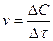 ). Средняя скорость реакции неодинакова в интервале времени τ. Чем меньше рассматриваемый интервал времени, тем ближе определяемая скорость к скорости истинной (при Dτ ® 0 истинная скорость равна производной концентрации по времени:
). Средняя скорость реакции неодинакова в интервале времени τ. Чем меньше рассматриваемый интервал времени, тем ближе определяемая скорость к скорости истинной (при Dτ ® 0 истинная скорость равна производной концентрации по времени: 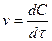 , т.е. это мгновенная скорость, или скорость в данный момент). Скорость химической реакции в зависимости от концентрации выражается законом действующих масс (Гульберг и Вааге): скорость гомогенной реакции при постоянной температуре пропорциональна произведению мольных концентраций реагирующих веществ, причем концентрация каждого данного вещества берется в степени, равной его стехиометрическому коэффициенту в уравнении реакции.
, т.е. это мгновенная скорость, или скорость в данный момент). Скорость химической реакции в зависимости от концентрации выражается законом действующих масс (Гульберг и Вааге): скорость гомогенной реакции при постоянной температуре пропорциональна произведению мольных концентраций реагирующих веществ, причем концентрация каждого данного вещества берется в степени, равной его стехиометрическому коэффициенту в уравнении реакции.
Так, для произвольной реакции
а A + b B = c C + d D
уравнением для расчета скорости прямой реакции будет:
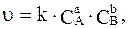 (5.1)
(5.1)
где k – постоянный для каждой реакции и данной температуры коэффициент пропорциональности между скоростью и концентрациями, называемый константой скорости реакции, причем, как следует из уравнения (5.1), υ = k при 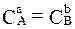 = 1. Константа скорости реакции не зависит от концентрации реагирующих веществ, но зависит от их природы, температуры процесса и наличия катализатора. Для гетерогенной реакционной системы, например
= 1. Константа скорости реакции не зависит от концентрации реагирующих веществ, но зависит от их природы, температуры процесса и наличия катализатора. Для гетерогенной реакционной системы, например
С(т) + Н2О(г) = СО(г) + Н2 (г),
скорость реакции будет зависеть от степени развития поверхности (измельчения) твердого угля, что учитывается константой скорости реакции, и для данной степени развития поверхности скорость будет определяться только концентрацией паров воды: υ = k · С (Н2О).
Скорость газовых реакций будет зависеть от давления. Так, при увеличении давления в два раза для системы Н2 + I2 = 2НI концентрации водорода и паров йода также увеличатся в два раза, следовательно, скорость реакции возрастет в четыре раза.
Сумма всех показателей степеней при концентрациях в уравнении для скорости реакции (5.1), т.е. a + b = n, называется порядком реакции.
Для характеристики простейших реакций, протекающих в одну стадию, введено понятие об их молекулярности. Молекулярность реакции определяется минимальным числом молекул, одновременно участвующих в элементарном акте данной реакции. Молекулярность и порядок реакции численно совпадают только для простейших реакций. Для сложных процессов эти характеристики реакции будут отличаться (порядок реакции меньше ее молекулярности). Следовательно, формальное понятие о порядке реакции в большинстве случаев не отражает ее сложного механизма, т.е. наличия нескольких промежуточных элементарных реакций (стадий). Однако знание экспериментального порядка реакции позволяет судить о ее предполагаемом механизме путем сопоставления расчетных и экспериментально наблюдаемых значений величины n. Когда порядок реакции, найденный экспериментально, не соответствует числу моль реагентов, участвующих в реакции, то это говорит о том, что реакция не является элементарным процессом, а протекает по сложному механизму. Для сложного механизма скорость суммарной реакции определяется скоростью наиболее медленной (лимитирующей) стадии многоступенчатого процесса. Таким образом, если реакция протекает в одну стадию, то порядок ее равен молекулярности; если реакция протекает в несколько стадий, то порядок каждой из стадий реакции равен молекулярности только этой стадии. Следовательно, экспериментальное определение порядка реакции может служить методом изучения ее механизма.
Если для осуществления элементарного акта необходима всего одна частица (молекула) А, то такая реакция называется мономолекулярной, и для нее υ = kCА. Для элементарного процесса с одновременным участием двух частиц реакция будет называться бимолекулярной (υ = k·CA·CB, или (при СА = СВ =Ci) υ = k 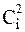 ) и т.д.
) и т.д.
Хотя скорость реакций пропорциональна частоте столкновений между молекулами, к реакциям приводят только столкновения между активными молекулами, средняя энергия которых превышает среднюю энергию участников реакции. При сообщении молекулам некоторой энергии активации Е (избыточная энергия над средней) уменьшается потенциальная энергия взаимодействия атомов в молекулах, связи внутри молекул ослабевают, молекулы становятся реакционноспособными. Энергия активации не обязательно подводится извне, она может быть сообщена некоторой части молекул путем перераспределения энергии при их столкновениях. По Больцману, среди N молекул находится следующее число активных молекул N обладающих повышенной энергией:
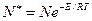 , (5.2)
, (5.2)
где Е – энергия активации, показывающая тот необходимый избыток энергии, по сравнению со средним уровнем, которым должны обладать молекулы, чтобы реакция стала возможной; остальные обозначения общеизвестны.
При термической активации для двух температур T1 и T2 отношение констант скоростей будет:
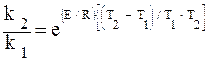 , (5.3)
, (5.3)
откуда 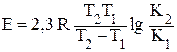 ,(5.4)
,(5.4)
что позволяет определять энергию активации по измерению скорости реакции при двух различных температурах Т1 и Т2.
Расчеты с использованием теоретического уравнения (5.3) подтвердили найденное ранее эмпирическим путем правило о том, что повышение температуры на 100 увеличивает скорость реакции в 2 – 4 раза (приближенное правило Вант-Гоффа). Число, показывающее, во сколько раз увеличивается скорость реакции (следовательно, и константа скорости) при увеличении температуры на 100 называется температурным коэффициентом реакции:
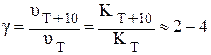 . (5.5)
. (5.5)
или 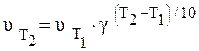 . (5.6)
. (5.6)
Это означает, например, что при увеличении температуры на 1000 для условно принятого увеличения средней скорости в 2 раза (g = 2) скорость реакции возрастает в 210, т.е. приблизительно в 1000 раз, а при g = 4 –в 410, т.е. в 1000000 раз. Правило Вант-Гоффа применимо для реакций, протекающих при сравнительно невысоких температурах в узком их интервале. Резкое возрастание скорости реакции при повышении температуры объясняется тем, что число активных молекул при этом возрастает в геометрической прогрессии.
Можно показать, что между lg k и 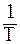 имеется линейная зависимость:
имеется линейная зависимость:
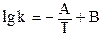 (уравнение Аррениуса), (5.7)
(уравнение Аррениуса), (5.7)
где А = const, В = const.
Величина А определяется соотношением: 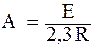 . (5.8)
. (5.8)
Величина В определяется по числу столкновений между молекулами (С):
В = lg С. (5.9)
Уравнение Аррениуса справедливо для более широкого интервала температур, чем температурный интервал, определяемый правилом Вант-Гоффа.
Постоянные А и В в уравнении (5.7) можно найти используя графическую зависимость константы скорости реакции от температуры (тангенс угла наклона прямой есть величина А, а отсекаемый ею на оси lg k отрезок позволяет найти величину В). Таким путем можно определять энергию активации Е изучаемой реакции.
Катализ – это изменение скорости реакции под действием веществ, которые, участвуя в процессе, к концу его остаются химически неизменными. Такие вещества называются катализаторами. Катализатор только ускоряет наступление равновесия, но не смещает его, и поэтому в присутствии катализатора нельзя получить в равновесной смеси больше продуктов реакции, чем без него. Различают два типа катализа: гомогенный (катализатор и реакционная смесь образуют гомогенную фазу) и гетерогенный (катализатор находится в виде самостоятельной фазы, и реакция протекает на его поверхности). Скорость реакции изменяется путем уменьшения энергии активации данной реакции. Механизм действия катализаторов многообразен, но часто он заключается в образовании с одним из участвующих в реакции веществ промежуточного соединения, которое затем реагирует с другим веществом с образованием конечного продукта и свободного катализатора. При этом энергия активации каждой из стадий меньше энергии активации реакции, идущей в отсутствие катализатора.
Скорость гомогенных каталитических реакций (в качестве катализаторов здесь часто выступают растворы активных веществ в воде или органических растворителях) пропорциональна концентрации добавленного катализатора, хотя количество последнего обычно невелико. Во многих случаях гомогенный катализ может быть вызван ионами водорода или гидроксила (кислотно-основной катализ). Так, при инверсии тростникового сахара (расщепление его на глюкозу и фруктозу) по реакции
С12Н22О11(сахар) + Н2О = С6Н12О6 (глюкоза) + С6Н12О6 (фруктоза),
энергия активации ее составляет 133,76 кДж/моль, тогда как в присутствии катализаторов (ионов водорода) она снижается до 107,01 кДж/моль и даже до 39,29 кДж/моль – в присутствии фермента сахаразы.
В гетерогенном катализе катализатор обычно представляет собой твердое вещество, а вещества, участвующие в реакции, – жидкости или газы. Реакция протекает на поверхности катализатора, адсорбирующего одно или несколько реагирующих веществ, которые образуют с поверхностью нестойкие промежуточные соединения (химическая адсорбция). Затем молекулы адсорбированных веществ вступают в целевую реакцию, что сопровождается уменьшением энергии активации. Свойства молекулы адсорбированного вещества в энергетическом смысле заметно изменяются и при простой физической адсорбции, т.е. протекающей без образования промежуточного комплекса. В этом случае происходит «разрыхление», ослабление связей у реагирующих веществ, что также приводит к снижению энергии активации. При гетерогенном (поверхностном) катализе важную роль (для активности катализатора) играют свойства поверхности – удельная поверхность, химический состав поверхностного слоя, его структура (неоднородность, существование активных центров) и др. С этими факторами часто бывает связана и значительная избирательность действия гетерогенных катализаторов.
Дополнительные вещества, повышающие активность катализатора, называются активаторами или промоторами. Вещества, понижающие активность катализаторов, называются каталитическими ядами.
Ферментативный катализ (биокатализ), играющий исключительную роль в жизнедеятельности животных и растений, реализуется в природе с помощью ферментов – полимерных веществ белковой природы. Ферменты состоят в основном(иногда полностью) из белков, т.е. они образованы из аминокислот с определенной пространственной структурой полипептидных цепей. В состав небелковой части фермента могут входить ионы металлов и некоторые органические вещества. При этом каталитической активностью обладает только определенный участок молекулы фермента – ее активный центр, образующий с молекулой реагирующего вещества промежуточное соединение, способное к дальнейшим превращениям. Отличительной чертой ферментов-катализаторов, наряду с их высокой эффективностью, является и резко выраженное дифференцированное каталитическое действие, что проявляется в ускорении только очень узкого круга реакций. Так, время «полупревращения» для реакции разложения мочевины водой при 25оС составляет 109c, а в присутствии фермента – уреазы 10-4c. Активность ферментов зависит в значительной мере от рН среды, концентрации фермента и температуры.
Комплексное соединение кобальта (витамин В12) необходимо для процессов кроветворения. Металлопорфирины железа входят в состав гемоглобина, а также ферментов каталазы, пероксидазы. Энзимы, гормоны, витамины являются активными биокатализаторами в биохимических процессах и участвуют в процессах пищеварения, различном биологическом окислении, спиртовом и уксуснокислом брожении и др.
Date: 2015-09-17; view: 720; Нарушение авторских прав