
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическое равновесие. Фазовое равновесие
|
|
В соответствии с законом действующих масс для произвольной реакции
а A + b B = c C + d D (3.1)
уравнение скорости прямой реакции можно записать:
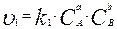 ,(3.2)
,(3.2)
а для скорости обратной реакции
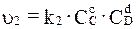 . (3.3)
. (3.3)
По мере протекания реакции (3.1) слева направо концентрации веществ А и В будут уменьшаться и скорость прямой реакции будет падать. С другой стороны, по мере накопления продуктов реакции C и D скорость реакции справа налево будет расти. Наступает момент, когда скорости υ 1 и υ 2 становятся одинаковыми, концентрации всех веществ остаются неизменными, следовательно,
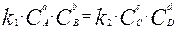 ,(3.4)
,(3.4)
откуда 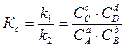 .(3.5)
.(3.5)
Постоянная величина Кс, равная отношению констант скоростей прямой и обратной реакций, количественно описывает состояние равновесия через равновесные концентрации исходных веществ и продуктов их взаимодействия (в степени их стехиометрических коэффициентов) и называется константой равновесия. Константа равновесия является постоянной только для данной температуры, т.е.
Кс = f (Т). Константу равновесия химической реакции принято выражать отношением, в числителе которого стоит произведение равновесных молярных концентраций продуктов реакции, а в знаменателе – произведение концентраций исходных веществ.
Если компоненты реакции (3.1) представляют собой смесь идеальных газов, то константа равновесия (Кр) выражается через парциальные давления компонентов:
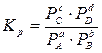 .(3.6)
.(3.6)
Соотношения (3.4) и (3.5) выражают закон действующих масс. Для перехода от Кр к Кс воспользуемся уравнением состояния P · V = n·R·T (см. уравнение 1.1). Поскольку
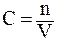 , то P = CRT.
, то P = CRT.
Тогда 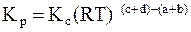 . (3.7)
. (3.7)
Из уравнения (3.7) следует, что Кр = Кс при условии, если реакция идет без изменения числа моль в газовой фазе, т.е. когда (с + d) = (a + b).
Если реакция (3.1) протекает самопроизвольно при постоянных Р и Т или V и Т, то значения DG и DF этой реакции можно получить из уравнений:
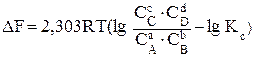 , (3.8)
, (3.8)
где С А, С В, С С, С D – неравновесные концентрации исходных веществ и продуктов реакции.
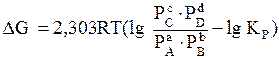 , (3.9)
, (3.9)
где Р А, Р В, Р С, Р D – парциальные давления исходных веществ и продуктов реакции.
Уравнения (3.8), (3.9) называются уравнениями изотермы химической реакции Вант - Гоффа. Это соотношение позволяет рассчитать значения DG и DF реакции, определить ее направление при различных концентрациях исходных веществ.
Необходимо отметить, что как для газовых систем, так и для растворов, при участии в реакции твердых тел (т.е. для гетерогенных систем) концентрация твердой фазы не входит в выражение для константы равновесия, поскольку эта концентрация практически постоянна. Так, для реакции
2СО (г) = СО2 (г) + С(тв)
константа равновесия записывается в виде
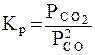 .
.
Зависимость константы равновесия от температуры (для температуры Т2 относительно температуры Т1) выражается следующим уравнением Вант-Гоффа:
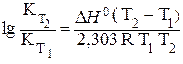 ,(3.10)
,(3.10)
где DН° – тепловой эффект реакции.
Для эндотермической реакции (реакция идет с поглощением тепла) константа равновесия увеличивается с повышением температуры, система как бы сопротивляется нагреванию. Качественно направление этого изменения определяется принципом (правилом) Ле-Шателье: при повышении температуры равновесное состояние сдвигается в сторону эндотермического процесса (происходит поглощение энергии); при понижении температуры происходит сдвиг равновесия в обратную сторону – реакция пойдет справа налево (по отношению к установившемуся соотношению исходного и конечного количества реагентов в равновесной системе), т.е. в сторону экзотермического процесса (идет выделение энергии за счет обратной реакции).
Влияние других факторов на химическое равновесие, кроме температуры, также обусловлено правилом Ле-Шателье:
если на систему, находящуюся в термодинамическом равновесии, воздействовать путем изменения каких-либо условий, при которых это равновесие существует, то в системе возникнет реакция, ослабляющая эффект произведенного воздействия.
На увеличение концентрации одного из реагентов равновесная система отреагирует таким образом, чтобы уменьшилось это изменение, то есть реакция пойдет в направлении уменьшения концентрации этого компонента. В частности, для газовых систем, если число молей реагентов равно числу молей продуктов реакции (в соответствии со стехиометрическим уравнением), то константа равновесия не будет зависеть от увеличения или уменьшения давления, т.е. смещения положения равновесия при изменении давления не произойдет. Однако, если в результате реакции происходит изменение числа моль исходных веществ относительно числа моль продуктов реакции, то увеличение давления смещает равновесие в направлении той реакции, которая приведет к уменьшению полного числа моль. При понижении давления эта реакция пойдет в сторону увеличения числа моль, и система в итоге придет к новому состоянию равновесия (численное значение константы равновесия в новом равновесном состоянии системы будет тем же самым). Таким образом, принцип смещения равновесия – это принцип уменьшения системой эффективности воздействующих на нее сил.
Химическая система является гомогенной (однофазной), если она физически однородна (смесь газов в воздухе). Если система состоит более чем из одной фазы, то она называется гетерогенной, например, лед вместе с водой. Фаза – это гомогенная часть гетерогенной системы, ограниченная поверхностью раздела (фаза льда в водной фазе) и обладающая одинаковыми химическим составом и термодинамическими свойствами. Характерным является то, что по обе стороны от границы раздела фаз параметры каждой фазы имеют резкие различия. Так, в системе Н2О(кр) – Н2О(ж) – Н2О(г) могут одновременно сосуществовать три фазы – твердая, жидкая и газообразная (в точке таяния льда). Число фаз обозначают (Ф).
Для гетерогенных систем важным понятием является число степеней свободы ( C), или вариантность. Степень свободы – это число термодинамических параметров состояния (Р, Т, концентрация), которые можно изменять, и при этом не изменится число сосуществующих в системе фаз, находящихся в состоянии равновесия.
Системы могут быть однокомпонентными или многокомпонентными. Число компонентов (К) определяется минимальным количеством веществ, посредством которых можно выразить состав любой фазы. Например, из водного раствора нитрата цинка можно выделить воду, Zn(NO3) 2 и ряд кристаллогидратов. Но эта система является двухкомпонентой, поскольку любые фазы можно получить из Н2О и Zn(NO3) 2.
В соответствии с правилом фаз Гиббса для равновесной гетерогенной системы число фаз плюс число степеней свободы равно числу компонентов плюс два:
Ф + С = К + 2. (1.43)
Так, для однокомпонентой системы имеем: С = К + 2 – Ф = 3 – Ф. Тогда при наличии только одной фазы число степеней свободы равно 2, и система будет бивариантна, т.е. гомогенность системы будет сохраняться при независимом изменении двух параметров – давления и температуры. Примерами таких систем являются вода или водяной пар. При равновесии в однокомпонентной, но двухфазной системе число степеней свободы С = 3 – 2 = 1, т.е. данная система уже моновариантна, и фазовое равновесие в ней будет сохраняться при независимом изменении только одного из параметров, например температуры. В качестве примеров таких систем могут служить системы вода «пар или лед «пар. Наконец, если система не имеет ни одной степени свободы, то она будет называться нонвариантной, например система, в которой сосуществуют лед, вода и пар.
Для наглядного изображения фазовых равновесий в конкретных системах используется графический метод, например прямоугольная система координат: на оси абсцисс откладывается абсолютная температура, а на оси ординат – давление, строится диаграмма. Такое изображение фазовых равновесий называют фазовой диаграммой или диаграммой состояния.
Рассмотрим диаграмму состояния воды. Внутри диаграммы наносятся точки, отвечающие экспериментально найденным значениям Р и Т, характеризующим фазовые равновесия между, например, двумя фазами. Тогда каждой фазе в однокомпонентной системе будет отвечать определенное поле на диаграмме, а различные состояния межфазного равновесия будут расположены на кривой Р = f (Т). По одну сторону от этой кривой система находится только в виде одной фазы, по другую сторону располагается рассматриваемый компонент в виде второй фазы. Каждая точка на этой линии характеризует, например, для системы жидкость – пар, конкретное значение температуры, которой отвечает только одно равновесное значение давления насыщенного пара жидкости. Тогда можно утверждать, что на этой линии число С = 1, следовательно, в соответствии с правилом фаз, независимо можно изменять лишь один параметр. Отсюда, если изменить Т, то межфазное равновесие сохранится при условии, что Р самопроизвольно изменится строго определенным образом. Для данной однокомпонентной системы аналогично можно рассмотреть равновесия между жидкостью и твердым телом, между твердым телом и паром. В итоге получим совокупность кривых, которые и образуют диаграмму состояния данного вещества.
Диаграммы состояния двухкомпонентных систем имеют более сложное строение, для получения представления о них необходимо обратиться к рекомендуемой литературе.
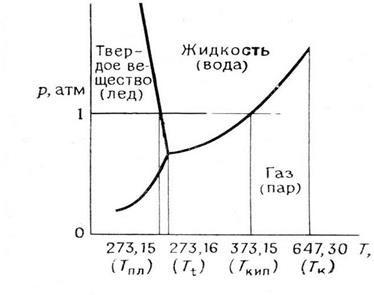
Диаграмма состояния позволяет решать ряд практических вопросов. В частности, с ее помощью можно проследить, как при изменении общего давления (при Т = const) изменяются равновесные составы жидкости и пара, а также и соотношение их масс. С помощью диаграммы состояния легко решается вопрос, в каком состоянии – жидком, газообразном или гетерогенном – будет находиться данная, например бинарная, система при заданных температуре, давлении и общем составе.
Date: 2015-09-17; view: 886; Нарушение авторских прав