
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Программа курса. «физическая химия» Краткая характеристика газов
|
|
«Физическая химия»
- Краткая характеристика газов
Энергетическое взаимодействие между частицами вещества (атомами, молекулами, ионами) определяет существование его в твердом, жидком или газообразном состояниях (агрегатное состояние вещества). Взаимодействия между частицами у вещества в газообразном состоянии очень слабые, они усиливаются, когда вещество переходит в жидкое или твердое состояние. Если силы межчастичного притяжения больше энергии тепловых колебаний – вещества находятся в твердом состоянии. Твердое кристаллическое состояние характеризуется упорядоченной структурой (геометрически правильное расположение частиц в пространстве).
Если силы взаимодействий между частицами уже не способны преодолевать тепловые колебания, существующие связи между частицами рвутся и образуются новые, частицы смещаются относительно друг друга, и хотя контакт между ними сохраняется, нарушается геометрически правильная структура – это жидкое состояние. Таким образом, частицы в жидкости взаимосвязаны, но структура ее не определена, хотя на близком расстоянии от определенной частицы расположение других частиц может быть упорядоченным. Твердое и жидкое состояния называют конденсированным состоянием.
Если же частицы вещества не связаны друг с другом – это газообразное состояние.
Идеальный газ – это идеализированное состояние реальных газов при бесконечно малом давлении (концентрации). Принимается, что между частицами идеального газа нет никаких взаимодействий – ни притяжения, ни отталкивания. Частицы свободны и перемещаются беспрепятственно (неупорядоченное состояние), причем собственный объем молекул газа настолько мал по сравнению с объемом, в котором эти молекулы располагаются, что его можно не учитывать. Понятие идеальное состояние принято для упрощения первичного математического описания систем, а переход к реальному состоянию осуществляется путем введения в уравнения для идеального газа необходимых поправок (учитывая межчастичные взаимодействия и объем частиц).
В твердом состоянии вещество с трудом изменяет объем и форму (слабо сжимается и ничтожно мало деформируется), в жидком – с трудом изменяет объем, но легко может менять форму (чрезвычайно слабо сжимается, но свободно деформируется), а в газообразном – легко изменяет как объем, так и форму.
При очень высокой температуре (сотни тысяч градусов) энергия столкновений между частицами газа настолько велика, что молекулы разрушаются, а атомы теряют электроны, в результате чего образуется плазма, состоящая из ядер и электронов. Плазма рассматривается как четвертое – плазменное состояние материи (например, вещества внутри Солнца).
Газовые системы являются наиболее наглядными моделями при изучении законов термодинамики и кинетики. От свойств идеальных газов легко перейти к свойствам идеальных жидких растворов, а затем и к свойствам реальных растворов.
Уравнение состояния идеального газа определяет соотношение между давлением, температурой и объемом газа. Так, для случая переменных параметров состояния P, V и T они связаны между собой следующим образом:
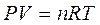 (1.1)
(1.1)
где n – число моль идеального газа в объеме V, т.е. 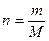 , здесь m – масса газа, г;
, здесь m – масса газа, г;
M – молярная масса газа, г/моль;
R – универсальная газовая постоянная (коэффициент пропорциональности), которую для 1 моль идеального газа (из уравнения 1.1) можно выразить:
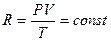 . (1.2)
. (1.2)
В численном выражении (в системе СИ) универсальная газовая постоянная равна 8,31 Дж/моль . К, а учитывая, что 1 кал = 4,18 Дж, R = 1,987 кал/моль·К. Во внесистемных единицах R = 0,082 л·атм/моль·К.
Если в объеме V смешано несколько идеальных газов, то каждый из них будет оказывать на стенки сосуда свое собственное (парциальное) давление – такое, как если бы только один газ занимал весь объем. Тогда наблюдаемое полное давление будет равно сумме парциальных давлений каждого газа (закон Дальтона), и уравнение состояния для смеси газов А, В и С в объеме V при температуре Т примет вид:
PV = (PА + РВ + РС)V = (nА + nВ + nC)RT, (1.3)
где РА, РВ и РС – парциальное давление индивидуальных газов А, В и С, Па;
nA, nB и nC – количество моль отдельных газов А, В и С.
Отметим, что для реальных газов (с более высокими, т.е. реальными, концентрациями молекул) должны учитываться взаимные притяжения газовых молекул и их собственный объем, который будет занимать уже заметную долю от всего объема. Тогда объем, в котором движутся молекулы реального газа, будет не V, а V – b, где константа b – учет суммарного собственного объема молекул и их взаимного отталкивания (на малых расстояниях). Кроме того, вследствие наличия в реальном газе сил межмолекулярного притяжения, давление реального газа должно быть ниже давления идеального газа, что также необходимо учитывать, т.е. вводить еще один дополнительный коэффициент а, относящийся к свойству молекул конкретного реального газа. Тогда уравнение состояния (1.4) для реального газа принимает вид (Ван-дер-Ваальс):
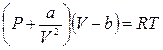 , (1.4)
, (1.4)
где a и b – константы, характеризующие свойства молекул данного реального газа; находятся экспериментальным путем.
Date: 2015-09-17; view: 508; Нарушение авторских прав