
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Температурная зависимость константы скорости реакции
|
|
Наглядные представления о зависимости скорости химической реакции от температуры дает правило Вант – Гоффа, согласно которому при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2-4 раза. Это правило первоначально было установлено для реакций, протекающих в растворах при невысоких температурах, и связано с понятием температурного коэффициента скорости реакции γ, определяемого соотношением: 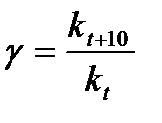
Количественная зависимость константы скорости реакции от температуры была впервые предложена Вант - Гоффом в 1827г., который, основываясь на изменении константы равновесия с температурой, указал, что подобные соотношение должно сохраняться и для константы скорости реакции.
Эта идея была развита Аррениусом, который успешно применил ее к рассмотрению большого числа реакций, поэтому следующее уравнение называют уравнением Аррениуса:
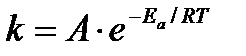 , где
, где
Еа – аррениусовская, т.е. экспериментальная энергия активации.
А – предэкспоненциальный множитель
Величины Еа и А важнейшие характеристики химической реакции.
Вант – Гофф, используя уравнение, объяснил, почему наблюдающаяся зависимость имеет такой вид.
Напишем уравнение изохоры реакции, которое показывает зависимость константы равновесия от температуры при 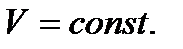
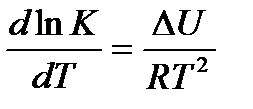 , где
, где
К – константа равновесия:
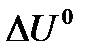 - тепловой эффект реакции при V=const.
- тепловой эффект реакции при V=const.
Как известно для обратимой реакции:
k1
А+В ↔С+D,
k2
идущей в газообразной фазе или в разбавленном растворе константа равновесия равна:
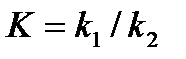
Запишем тепловой эффект как разность: 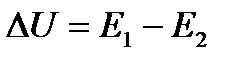 , тогда уравнение изохоры примет вид:
, тогда уравнение изохоры примет вид:
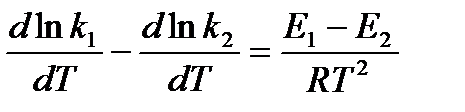
Последнее соотношение можно разбить на два уравнения:
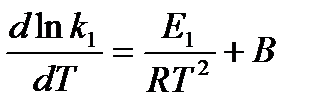 и
и  , где
, где
 и
и 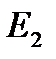 имеют размерность энергии.
имеют размерность энергии.
В - вличина, имеющая одинаковое значение для прямой и обратной реакции, В=О на основании опытных данных.
Тогда для каждой из реакций можно записать:
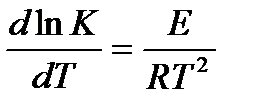
Так как все взаимодействия идут через стадию образования активных частиц, характеризующихся определенным значением энергии, постоянным для каждой реакции, можно заменить в уравнении Е на величину Еа и перейти к интегральной форме:
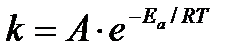
Для объяснения физического смысла величины 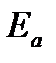 Аррениус предположил, что в реакцию способны вступать не все частицы, а лишь те из них, которые находятся в активированном состоянии.
Аррениус предположил, что в реакцию способны вступать не все частицы, а лишь те из них, которые находятся в активированном состоянии.
Молекулы в активированном состоянии возбуждении за счет избытка энергии и не устойчивы, а в нормальном - стабильны. Между нормальными и активированными молекулами существует равновесие. Доля частиц в возбужденном состоянии относительно мала. Число же частиц в нормальном состоянии практически равно общему числу частиц. Поскольку процесс активации эндотермический, то константа равновесия для этого процесса растет с увеличением температуры. Поэтому возрастает концентрация частиц в активированном состоянии и скорость реакции.
Энергию 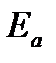 можно определить как тепловой эффект процесса активации.
можно определить как тепловой эффект процесса активации.
Энергия активации – это та энергия, которую должны накопить нормальные молекулы, чтобы иметь возможность прореагировать.
Date: 2015-09-17; view: 908; Нарушение авторских прав