
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теория переходного состояния
|
|
Положения теории переходного состояния (ТПС) разработаны Г.Эйрингом и М.Поляни в 30- х годах 20- го столетия.
Они получили выражение для расчета константы скорости и энергии активации простых реакций. Расчеты показали, что при сближении в процессе столкновения частиц А и В возрастает их потенциальная энергия Е 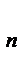 .На некотором расстоянии rа энергия Е
.На некотором расстоянии rа энергия Е 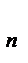 достигает максимума Еmax.
достигает максимума Еmax.
На этом расстоянии происходит реакция и образуются новые частицы С и D, которые затем удаляются и их потенциальная энергия падает (рис.10).
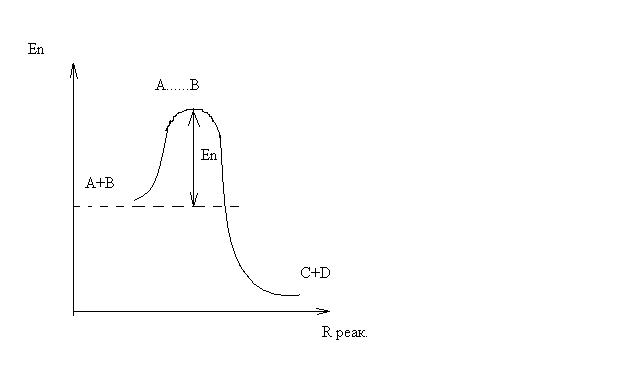
 Рис.10
Рис.10
Зависимость потенциальной энергии Еn от расстояния rреак, определяющего взаимное расположение атомов в реагирующих и образующихся частицах называется кривой потенциальной энергии.
Расстояние  называется координатой реакции.Особенность кривых потенциальной энергии – это наличие максимума. Высота этого максимума равна энергии активации
называется координатой реакции.Особенность кривых потенциальной энергии – это наличие максимума. Высота этого максимума равна энергии активации 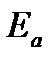 . Исходя из формы кривой потенциальной энергии, величину
. Исходя из формы кривой потенциальной энергии, величину 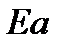 называют часто энергетическим или активационным барьером реакции.
называют часто энергетическим или активационным барьером реакции.
На вершине активационного барьера реагирующие частицы А и В образуют активированный комплекс (А … В), который существует непродолжительное время и быстро распадается, образуя продукты С и D:
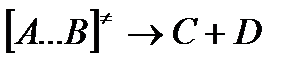
Активированный комплекс находится в равновесии с реагирующими частицами:
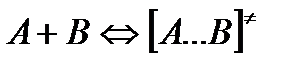
Константа активированного равновесия равна:
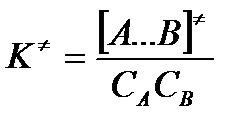
Отсюда следует, что концентрация 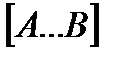 связана с концентрацией реагентов специального образования следующим образом:
связана с концентрацией реагентов специального образования следующим образом:

Скорость реакции пропорциональна концентрации этих комплексов, т.к. продукты реакции С и D образуются из этих комплексов:
W= 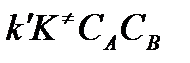
k´-коэффициент пропорциональности,  равный RT/ (N
равный RT/ (N  ),где
),где
R- универсальная газовая постоянная;
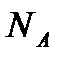 - число Авогадро;
- число Авогадро;
h- постоянная Планка;
Сравнивая полученное выражение с законом действующих масс для скорости реакции W=kCa∙CB, получим выражение для константы скорости.
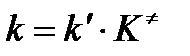
Чтобы получить зависимость теоретической константы скорости от температуры, следует использовать уравнение изотермы реакции Вант – Гоффа
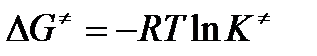 где
где
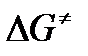 энергия Гиббса активации;
энергия Гиббса активации;
В соответствии с определением  равна:
равна:
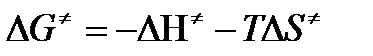 , где
, где
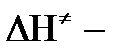 энтальпия активации;
энтальпия активации;
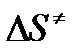 - энтропия активации;
- энтропия активации;
Равенство левых частей позволяет приравнять правые
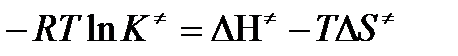
или
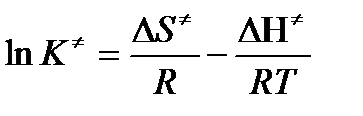
или
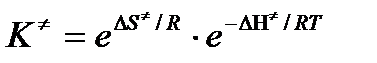
Подставим полученные значения К 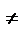 в выражение для константы скорости:
в выражение для константы скорости:
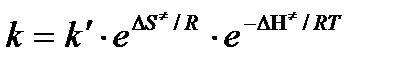
Сравнение последнего выражения с уравнением Аррениуса показывает, что предэкспонента равна:
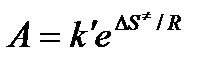 ,
,
а энергия активации: Еа = 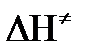
Таким образом, ТПС позволяет связать кинетику химических реакций с термодинамическими характеристиками процесса активации 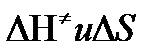 .
.
Из соотношения 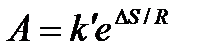 следует, что предэкспонента в уравнении Аррениуса определяется изменением энтропии в процессе образования активированного комплекса. Чем больше значение
следует, что предэкспонента в уравнении Аррениуса определяется изменением энтропии в процессе образования активированного комплекса. Чем больше значение 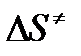 , тем больше А, тем быстрее протекает реакция.
, тем больше А, тем быстрее протекает реакция.
Изменение энергии взаимодействия между атомами, из которых состоят эти частицы, определяются энтальпией активации 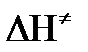
Возрастание этой величины сопровождается таким же возрастанием энергии активации Еа и уменьшением скорости реакции и наоборот.
Date: 2015-09-17; view: 698; Нарушение авторских прав