
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

д. Политропные процессы
|
|
Политропным называется процесс, протекающий при постоянном значении истинной теплоемкости: c=dq/dt=const.
1. Вывод уравнения процесса аналогичен выводу уравнения адиабатного процесса. Используются две формы уравнения 1-го закона термодинамики для идеального газа (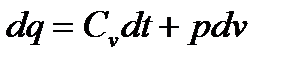 и
и 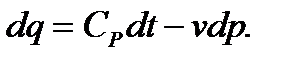 ). Заменяя в этих уравнениях dq из формулы (5.9), получим
). Заменяя в этих уравнениях dq из формулы (5.9), получим 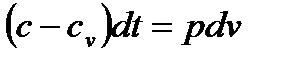
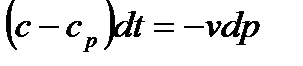 .
.
Разделим правое уравнение на левое по частям: 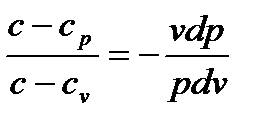 .
.
Обозначая 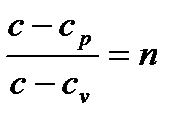 , будем иметь дифференциальное уравнение
, будем иметь дифференциальное уравнение 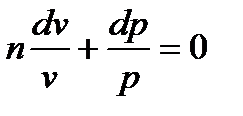
Поэтому решение его будет
 (6.36)
(6.36)
Величина n называется показателем политропы. Если считать Сp и Сv не зависящими от температуры, то, по определению политропного процесса, будет соблюдаться условие n=const. Часто понятие политропного процесса устанавливается непосредственно на основе уравнения (6.36). Именно политропным называют процесс, при котором параметры состояния p и v связаны уравнением (6.36), где показатель n есть постоянная. Из того факта, что уравнения адиабатного и политропного процессов имеют одинаковый вид, следует, что полученные на их основе равенства будут также формально одинаковы; нужно только всюду заменить k на n:
2. 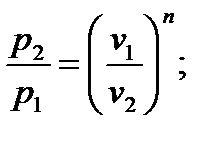
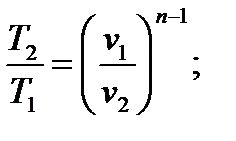
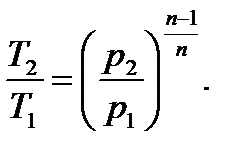
3. 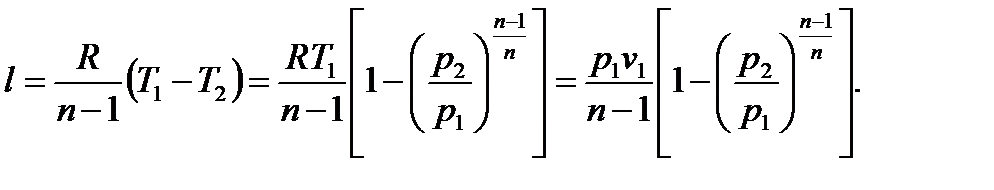
 (6.37)
(6.37)
4. Формула теплоемкости политропного процесса выводится из определения показателя политропы:
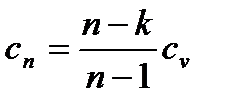 . (6.38)
. (6.38)
Таким образом, зная показатель политропы и изохорную теплоемкость, можно вычислить теплоемкость любого политропного процесса. Количество теплоты определяется на основе понятия теплоемкости по обычной формуле:
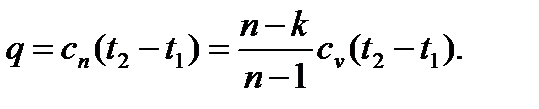
5. Изменение энтропии найдем, заменяя в (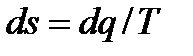 ) dq на cndT и интегрируя полученное равенство:
) dq на cndT и интегрируя полученное равенство: 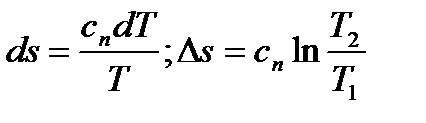 или, с учетом (6.38),
или, с учетом (6.38),
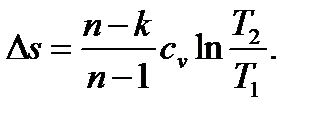
6. Будем придавать показателю политропы n в уравнении (6.36) частные значения. При n=0 получим p=const – уравнение изобарного процесса. При n=1 будет pv=const – уравнение изотермического процесса T=const. При n=k уравнение (6.36) преобразуется в (6.29) – уравнение адиабатного процесса. Возведем теперь обе части равенства (6.36) в степень 1/ n и положим n → ± ∞; при этом 1/ n обратится в ноль и уравнение (6.36) перейдет в уравнение изохорного процесса v=const. Таким образом, все изученные ранее процессы являются лишь частными случаями политропного процесса. Следовательно, понятие политропного процесса является обобщающим. При выводе уравнения политропы никаких ограничений на величину n не накладывалось, поэтому можно считать, что n может принимать бесчисленное множество значений в интервале от -∞ до +∞ и, следовательно, существует бесчисленное множество политропных процессов.
Перейдем к изображению политропных процессов в pv - диаграмме. Предварительно установим связь между показателем политропы и тангенсом угла наклона касательной к политропе в заданной точке (p1,v1). Для этого найдем производную dp/dv с помощью уравнения (6.36), считая постоянную в правой части уравнения равной 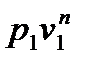 :
:
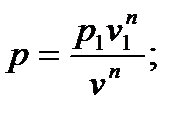
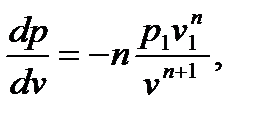 при
при 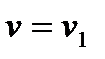
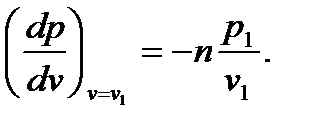 (6.39)
(6.39)
Из формулы (6.39) непосредственно вытекают следующие правила:
А. Знак тангенса угла наклона касательной противоположен знаку показателя политропы, т.е. политропы с положительным показателем располагаются во втором и четвертом квадрантах диаграммы pv, а политропы с отрицательным показателем – в первом и третьем.
Б. В pv -диаграмме адиабата (n=k >1), проходящая через некоторую точку, расположена круче изотермы (n=1), проходящей через ту же точку.
В. При переходе от одной политропы к другой по часовой стрелке показатель политропы изменяется от -∞ (на изохоре) через 0 до +∞ (на изохоре). Различные политропы в pv -диаграмме изображены на рис. 6.7,а.
Изобразим также известные нам из предыдущего изложения политропы в Ts - диаграмме (рис. 6.7,б). Легко заметить, что порядок расположения политроп в Ts – диаграмме такой же, как и в pv - диаграмме, т.е. при переходе от одной политропы к другой по часовой стрелке показатель политропы возрастает от -∞ до +∞.
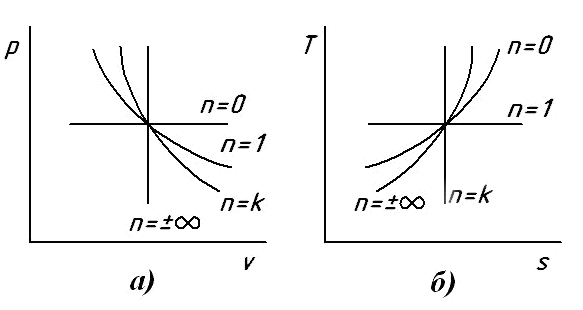
Рис. 6.7. Изображение различных политроп
Из равенства  можно получить выражение для тангенса угла наклона касательной к политропе в Тs - диаграмме:
можно получить выражение для тангенса угла наклона касательной к политропе в Тs - диаграмме: 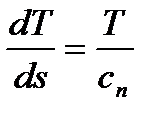 .
.
Поскольку T есть величина существенно положительная, знак тангенса угла наклона касательной совпадает со знаком теплоемкости процесса. Отсюда следует, что политропы, расположенные во втором и четвертом квадрантах Тs - диаграммы, имеют отрицательную теплоемкость. Смысл отрицательной теплоемкости заключается в том, что в данном процессе при подводе теплоты температура тела уменьшается, и наоборот. При переходе от одной политропы к другой по часовой стрелке теплоемкость данного политропного процесса увеличивается от -∞ (на изотерме) через 0 до +∞ (на изотерме). Уточняя сказанное ранее, можно утверждать, что теплоемкость политропного процесса при n→1 стремится к ± ∞. Изображение процесса в Ts - диаграмме дает важную информацию о направлении преобразования энергии в данном процессе. В частности, можно установить направление теплообмена (подвод или отвод теплоты), знак изменения температуры и внутренней энергии, теплоемкости процесса. Поэтому полезно научиться строить в Ts - диаграмме примерный график процесса, заданного своим изображением в pv – диаграмме.
Date: 2015-09-18; view: 1488; Нарушение авторских прав