
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химические уравнения и стехиометрические
|
|
расчёты по ним
Задача 1. Определите объем водорода, который выделится при растворении 10 г алюминия в соляной кислоте при нормальных условиях.
Решение. Составляем уравнение реакции:
2 Al + 6 HCl = 2 AlCl3 + 3 H2.
Молярная масса алюминия равна 27 г/моль. Из уравнения реакции видно, что из 2 моль алюминия получается 3 моль водорода. При растворении 2 моль · 27 г/моль = 54 г Al выделяется водорода 3 моль · 22,4 л/моль = 67,2 л. Составляем пропорцию:
54 г Al – 67,2 л Н2,
10 г Al – х л Н2,
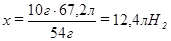 .
.
Задача 2. Хватит ли 1,5 л кислорода для сжигания 4,5 г магния при нормальных условиях?
Решение. Запишем уравнение реакции:
2 Mg + O2 = 2 MgO.
Молярная масса магния равна 24 г/моль, молярный объем газа 22, 4 л/моль. Из уравнения реакции видно, что для сжигания2 моль магния требуется 1 моль кислорода. Для сжигания
2 моль · 24 г/моль = 48 г Mg требуется
1 моль · 22,4 г/моль = 22,4 л О2,
тогда
48 г Mg – 22,4 л О2,
4,5 г Mg – х л О2,
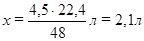 .
.
Следовательно, имеющихся 1,5 л О2 не хватит для сжигания 4,5 г магния, т.е. кислород взят в недостатке.
Задача 3. При прокаливании 30 г известняка получении 16 г оксида кальция. Определите массовую долю в процентах карбоната кальция в известняке.
Решение. Составляем уравнение реакции термического разложения карбоната кальция:
CaCO3 = CaO + CO2.
Молярные массы вещества равны: карбоната кальция –
100 г/моль, оксида кальция – 56 г/моль. Из уравнения реакции видно, что из 1 моль CaCO3 получается 1 моль CaO.
Запишем: для получения 1 моль · 56 г/моль = 56 г CaO требуется
1 моль ·100 г/моль = 100 г CaCO3;
для получения 1 моль ·56 г/моль = 16 г CaO требуется х г CaCO3, откуда
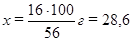 г CaCO3
г CaCO3
В данном образце (30 г) известняка содержится 28,6 г карбоната кальция, остальное – примеси.
Рассчитаем массовую долю карбоната кальция, для чего запишем:
30 г – 100 %,
28,6 г – у %,
откуда
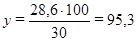 %
%
Задача 4. Железо может быть получено восстановлением оксида железа (III) алюминием. Какую массу алюминия и оксида железа (III) надо взять для получения 140 г железа?
Решение. Записываем уравнение реакции:
Fe2O3 + 2 Al = 2 Fe + Al2O3.
Из уравнения реакции следует: для получения 2 моль железа требуется 2 моль алюминия. Молярные массы железа – 56 г/моль, алюминия – 27 г/моль. Следовательно,
для получения 112 г Fe требуется 54 г Al,
для получения 140 г Fe требуется x г Al,
откуда
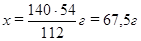
Из уравнения реакции следует: для получения 2 моль железа (112 г) требуется 1 моль оксида железа (160 г). Записываем:
112 г Fe – 160 г Fe2O3,
140 г Fe – у г Fe2O3,
откуда
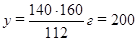 г Fe2O3
г Fe2O3
Date: 2015-09-18; view: 767; Нарушение авторских прав