
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Атомно-молекулярная теория
|
|
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
Определение химии
Современная химия является одной из естественных наук, изучающих окружающий для нас мир, и представляет собой систему отдельных научных дисциплин: общей и теоретической химии, аналитической химии, физической химии, геохимии и т.д.
Химия – наука, изучающая процессы превращения веществ, сопровождающиеся изменением структуры и состава, зависимость свойств веществ от их состава и строения, условия и пути превращения одних веществ в другие.
Главным объектом химии как науки являются вещества и их превращения.
Вещество – материальное образование, состоящее из элементарных частиц, имеющих собственную массу, или массу покоя.
Превращение одних веществ в другие путем изменения состава и химического строения называется химической реакцией.
Атомно-молекулярная теория
Основные положения атомно-молекулярного учения были разработаны и впервые применены в химии великим русским ученым М.В. Ломоносовым. Сущность учения М.В. Ломоносова сводится к следующему:
1.Все вещества состоят из «корпускул» (так М.В.Ломоносов называл молекулы)
2.Молекулы состоят из «элементов» (так М.В. Ломоносов называл атомы);
3.Частицы – молекулы и атомы – находятся в непрерывном движении. Тепловое состояние тел есть результат движения этих частиц;
4.Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных частиц – из различных атомов.
Атомно-молекулярное учение в химии окончательно утвердилось лишь в середине XIX в. на международном съезде химиков в г. Карлструэ в 1860 г., где были приняты основные определения понятий молекулы и атома.
Согласно современным знаниям, мы пользуемся следующими важнейшими понятиями:
Молекула – наименьшая частица денного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее состоянием и химическим строением.
Атом – элементарная частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлением: атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Химическим элементом называется каждый отдельный вид атомов. Важнейшей характеристикой атома является положительный заряд его ядра, численно равный порядковому номеру элемента в периодической системе элементов
Д.И. Менделеева. Значение заряда ядра служит отличительным признаком для различных видов атомов, что позволяет дать более точное определение понятия элемента.
Химический элемент – это определенный вид атомов с одинаковым, положительным зарядом ядра.
Массы атомов чрезвычайно малы. Однако современные методы исследования позволяют их определять с большой точностью. Так, масса атома водорода составляет
1,674·10 -27, кислорода – 2,667·10 -26, углерода – 1,993·10 -26 кг.
В химии традиционно применяют не абсолютные значения масс, а относительные. За единицу относительных масс с 1961 года принята атомная масса (сокращенно а.е.м.), представляющая собой 1/12 массы атома углерода – 12, т.е. изотопа углерода 12 С.
Относительная атомная масса химического элемента есть величина, равная отношению массы атома элемента к 1/12 массы атома углерода 12 С.
Относительную атомную массу элемента обозначают Аr.
Так,
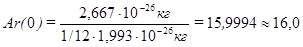
Относительная атомная масса – одна из основных характеристик химического элемента. Современные значения атомных масс приведены в периодической системе элементов Д.И.Менделеева.
Относительная молекулярная масса, так же как и атомная, выражается в атомных единицах массы (а. е. м.).
Относительная молекулярная масса вещества есть величина, равная отношению средней массы молекулы вещества к 1/12 массы атома углерода 12 С.
Относительную молекулярную массу обозначают Мr. Она численно равна сумме относительных атомных масс всех атомов, входящих в состав молекулы вещества, и легко подсчитывается по химической формуле вещества. Например, Мr (Н2О) будет слагаться из
2Аr (Н) = 2·1,00797 = 2,01594
Аr (О) = 1·15,9994 = 15,9994.
 Мr (Н2О) = 18,01524 ~ 18,0
Мr (Н2О) = 18,01524 ~ 18,0
Относительная молекулярная масса показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода – 12.
Моль. В международной системе единиц (СИ) за единицу количества вещества принят моль. Моль – это количества вещества, содержащее столько структурных единиц (молекул, атомов, ионов, электронов и др.), сколько содержится атомов в 0,012 кг изотопа углерода – 12.
Зная массу одного атома углерода 12 С(1,993 .10 -26 ), вычисляют число атомов NА в 0,012 кг углерода:

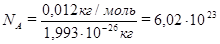 1 /моль
1 /моль
Число частиц в 1 моль любого вещества одно и то же. Оно равно 6,02·1023 и называется постоянной Авогадро (обозначается NА, размерность 1 /моль). Очевидно, что в 2 моль углерода будет содержаться 2·6,02·1023 атомов, а в 3 моль – 3·6,02·1023 атомов и т.д.
Молярная масса. Обычно ее обозначают буквой М. Молярная масса – величина, равная отношению массы вещества к количеству вещества. Она имеет размерность килограмм на моль или грамм на моль. Молекулярную массу вещества легко вычислить, зная массу молекулы. Так, если масса молекулы воды равна 2,99·10-26 кг , то молекулярная масса М(Н2О) =-2,99·1023 кг 6,02·1023 1/ моль = 0,018 кг / моль, или 18 г / моль.
В общем случае молекулярная масса вещества (грамм на моль), численно равна относительной атомной или относительной молекулярной массе этого вещества. Например, относительные атомные и молекулярные массы С, Fe, O2, Н2О соответственно равны 12, 56, 32, 18, а их молярная масса составляет соответственно 12, 56, 32, 18 г / моль.
Масса и количество вещества – понятия разные. Масса выражается в килограммах (граммах), а количество вещества – в молях. Между массой вещества (m, г), количества вещества
(n, моль) и молярной массой (М, г/моль) существуют простые соотношения:
m = n M, (1)
n = m/M, (2)
M = m/n, (3)
По этим формулам легко вычислить массу определенного вещества или определить количество вещества (молей) в известной массе его, или найти молярную массу вещества.
Date: 2015-09-18; view: 702; Нарушение авторских прав