
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Закон Авогадро. Следствия из закона Авогадро
|
|
Для объяснения простых соотношений между объемами регулирующих газов итальянский ученый А.Авогадро высказал гипотезу, которая впоследствии была подтверждена опытными данными, а потому стала называться законом Авогадро: в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Из закона Авогадро вытекают следующие следствия:
а) одинаковое число молекул газообразного вещества при одинаковых условиях занимает равные объемы;
б) 1 моль любого газа при одинаковых условиях занимает одинаковый объем (так как в 1 моле любого вещества всегда содержится 6,02·10 23молекул);
в) при нормальных условиях, т.е. температуре 273 К (00С) и давлении 101325 Па (760 мм рт.ст.) 1моль любого газа занимает объем 22,4 л.
Этот объем (22,4 л при н.у.) называется молярным объемом газа и обозначается Vm.
На основании закона Авогадро определяют молярные массы газообразных веществ.
Чем больше масса молекулы газа, тем больше масса одного и того же объема газа. Отношение масс равных объемов газов, в соответствии со следствиями из закона Авогадро, равно отношению их молярных масс:
m 1 :m 2 = M 1: M 2, (10)
где m 1 – масса определенного объема первого газа;
m 2 – масса такого же объема второго газа;
M 1 и M 2– молярные массы первого и второго газов.
Отношение массы определенного объема одного газа к массе такого же объема другого газа (взятого при тех же условиях) называется плотностью первого газа ко второму (обозначается буквой D):
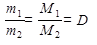 , (11)
, (11)
отсюда
M 1= M 2 D. (12)
Обычно плотность газа определяют по отношению к самому легкому газу – водороду (обозначается DН2). Молярная масса водорода равна 2,016 г/моль, или приближенно 2 г/моль. Поэтому получаем:
M = 2 DН2 (13)
Часто плотность газа определяется по отношению к воздуху (Dв). Хотя воздух является смесью газов, все же можно говорить о его средней молекулярной массе (так как состав воздуха известен и постоянен). Она равна 29 г/моль. В этом случае молярная масса изучаемого газа определяется выражение:
M = 29 D в (14)
Date: 2015-09-18; view: 834; Нарушение авторских прав