
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Закон эквивалентов
|
|
К концу 18 в. на основе изучения опытных данных было замечено, что элементы взаимодействуют друг с другом в строго определенных весовых отношениях. Так, с 1,008 весовыми частями (в.ч.) водорода соединяются 8,0 в.ч. кислорода, или 16 в.ч. серы, или 35,5 в.ч. хлора и т.д. Следовательно, эти весовые количества эквивалентны (равноценны) между собой. Понятие о соединительных весах элементов – их эквивалентах – впервые введено Дальтоном.
Эквивалентом элемента называется число, которое показывает, сколько весовых частей элемента соединяются с 8 в.ч. кислорода или 1 в.ч. водорода, или замещает (непосредственно или косвенно) те же количества водорода и кислорода в их соединениях при химических превращениях.
В настоящее время эквивалентом элемента называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в соединениях HCl, Н2S, NH3, CH4 эквивалент хлора, серы, азота, углерода равен соответственно 1 моль, 1/2 моля, 1/3 моля, 1/4 моля. Масса 1 эквивалента элемента называется его эквивалентной массой.
Так, в приведенных выше примерах эквивалентные массы хлора, серы, азота, углерода соответственно равны
35,5 г/ моль, 32/2 = 16 г/моль, 14/3 = 4,67 г/моль, 12/4 = 3 г/моль.
Между эквивалентом элемента Э, его атомной массой А и валентностью В существует зависимость
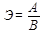 , (4)
, (4)
т.е. эквивалент элемента можно рассчитать, разделив атомную массу элемента на его валентность.
Закон эквивалентов формулируется так: элементы соединяются между собой и заменяют друг друга в количествах, пропорциональных их эквивалентам.
Математическая запись закона эквивалентов:
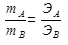 , (5)
, (5)
где mA и mB – массы взаимодействующих элементов А и В;
ЭА и ЭВ – эквиваленты элементов А и В.
Понятие эквивалента распространяется и на сложные вещества.
Эквивалентом вещества называется такое количество вещества, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Для вычисления эквивалентных масс сложных веществ на основе закона эквивалентов выведены следующие формулы:
Эоксида = Моксида /число атомов элемента х валентность элемента (6)
Экислоты = Мкислоты /Основность кислоты (7)
Эоснования = М основания /Кислотность основания (8)
Эсоли = Мсоли / число атомов элемента х валентность элемента (9)
где М – мольная масса соответствующего соединения.
Закон эквивалентов для сложных веществ формулируется так: химические вещества взаимодействуют между собой в количествах, пропорциональных их эквивалентам.
Date: 2015-09-18; view: 792; Нарушение авторских прав