
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Классификация. Определение: Белки – это сложные высокомолекулярные органические соединения , построенные из остатков аминокислот
|
|
Определение: Белки – это сложные высокомолекулярные органические соединения, построенные из остатков аминокислот, соединенных между собой амидными связями.
Белки разделяются на протеины (простые белки), в состав которых входят только остатки аминокислот и протеиды (сложные белки). Это белки построенные не только из аминокислот, но и из других веществ: сахаридов или остатков фосфорной кислоты и нуклеиновые кислоты.
Протеины классифицируются по трем группам.
1. По растворимости в воде:
Альбумины - растворимые в воде и разбавленных растворах солей.
Глобулины – мало растворимые в воде и растворимые в разбавленных растворах солей.
Проламины – нерастворимые в воде и растворимые в водном спирте.
Глютелины - нерастворимые в воде, в разбавленных растворах солей и водном спирте, растворимы в растворах кислот и щелочей.
Склеропротеины - нерастворимые в воде, в разбавленных растворах солей, водном спирте и в растворах кислот и щелочей.
2. Протеиды классифицируются по продуктам гидролиза:
Нуклеопротеиды – гидролизуются на протеины и нуклеиновые кислоты.
Фосфопротеиды - гидролизуются на протеины и фосфорную кислоту.
Глюкопротеиды - гидролизуются на протеины и углевод.
Хромопротеиды - гидролизуются на протеины и красящие вещества.
3. Все белки классифицируются по функциям в организме:
Резервные белки
Структурные белки
Белки, управляющие метаболизмом.
Как и аминокислоты, белки обладают амфотерным характером и изоэлектрической точкой. Положение изоэлектрической точки для белков может колебаться в широких пределах от кислой до сильнощелочной.
Все белки оптически активны. Большинство из них обладает левым вращением.
Существует ряд качественных цветных реакций на белки:
1. Ксантопротеиновая с азотной кислотой. Белки обработанные азотной кислотой дают желтое окрашивание.
2. Биуретовая с солями меди в присутствии щелочи. Белки дают фиолетовую окраску за счет образования комплексной соли.
3. Реакция Миллона. С раствором нитрата ртути в азотистой кислоте белки дают красное окрашивание.
4. Сульфгидрильная. При нагревании белков с раствором плюмбита натрия выделяется черный осадок сульфида свинца.
Белки построены из остатков 26 аминокислот. Аминокислоты делятся на заменимые, которые могут быть синтезированы организмом и незаменимые, которые человеческим организмом не синтезируются. Например, изолейцин и треонин.
Остатки аминокислот связаны в белковой молекуле амидными связями. Амидная связь в белках называется пептидной связью:
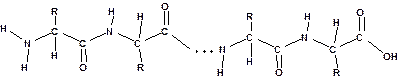
Карбоксильная группа одной молекулы аминокислоты образует амид, взаимодействуя с аминогруппой соседней молекулы аминокислоты. Отдельные пептидные звенья:
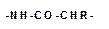
отличаются друг от друга только радикалами «R» при α-углеродном атоме.
Соединения, содержащие несколько аминокислотных остатков, называются пептидами. Соединения с большим количеством пептидных звеньев называются полипептидами.
При исследовании полипептидов в первую очередь выясняют, из каких аминокислот построена макромолекула, а также какая аминокислота является N-концевой (свободная аминогруппа), а какая является С-концевой (свободная корбоксильная группа).
Белки нацело гидролизуются в аминокислоты концентрированной соляной кислотой или 2% соляной кислотой при нагревании и при повышенном давлении. Гидролиз белков можно провести под действием щелочи. Выбор реагента зависит от того, какие конкретно аминокислоты необходимо получить из молекулы белка.
Определение N-концевой аминокислоты
Проводят с использованием 2,4-динитрофторбензола:
При взаимодействии 2,4-динитрофторбензола с пептидом фтор нуклеофильно замещается на концевую аминогруппу. Затем пептид подвергают гидролизу. Продукт взаимодействия концевой аминокислоты с 2,4-динитрофторбензолом выделяют и кислоту идентифицируют. В тех случаях, когда 2,4-динитрофторбензол неприменим - используют фенилизотиоцианат.
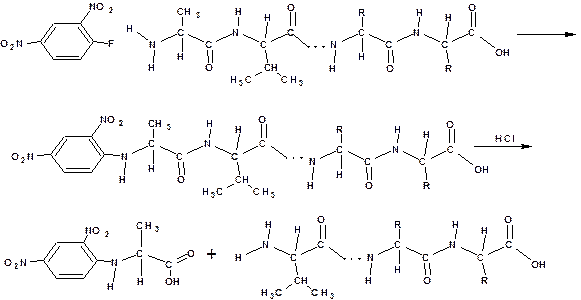
Определение С-концевой аминокислоты:
Для определения С-концевой аминокислоты (со свободным гидроксилом) пептид нагревают с гидразином при 1000С несколько часов. При этом все аминокислоты, кроме концевой, образуют гидразиды:
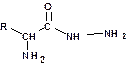
Аминокислоту, не образовавшую гидразид, выделяют и идентифицируют.
Более простой метод заключается в применении фермента карбоксипептидазы, который расщепляет пептидную связь только С-концевой аминокислоты. Ее можно выделить и идентифицировать.
Построение полипептидной цепи проводят по методу Э.Фишера. Метод основан на применении хлорангидридов α-галогензамещеннх кислот. Например, надо получить цепи:
Глицилаланин (Gly-Ala):
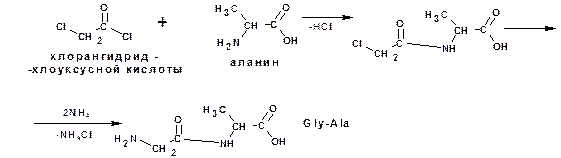
и аланилглицилвалин (Ala-Gly-Val):

Последовательность аминокислот, ковалентно связанных между собой в полипептиде, составляет так называемую первичную структуру белка. Но собственно полипептид белком еще не является. Пептиды неспособны к функционированию. Выполнять какие либо функции в организме способны более сложные системы построенные из нескольких полипептидных цепей, определенным образом связанных друг с другом. Надмолекулярные структуры, сформированные полипептидными цепями, характеризуются вторичной, третичной и четвертичной структурой белка.
Вторичная структура обусловлена водородными связями между пептидно не связанными кислородом карбонильной группы и водородом аминогруппы. Если карбонил и аминная группа принадлежат разным полипептидным цепям, то такая вторичная структура называется β-структурой. Если карбонил и аминная группа принадлежат одной и той же полипептидной цепи, то такая вторичная структура называется α-структура. Следствием α-структуры является существование полипептидной цепи в форме спирали навитой на циллиндр. Длина одного остатка 1,5 А0, длина шага спирали 5,4 А0. Водородные связи α-спирали образуются между каждой первой и четвертой аминокислотой.
Третичная структура белка формируется в результате складывания или свивания нескольких α-спиралей. При этом спирали удерживаются друг около друга за счет образования водородных связей, образованных боковыми амино-, гидрокси- и карбоксильными группами, а также дисульфидными связями и электростатически.
Четвертичная структура формируется как агрегат нескольких полипептидных цепей, имеющих вторичную и третичную структуры. Полипептидные цепи удерживаются в четвертичной структуре теми же силами, что и в третичной структуре.
Разрушение первичной вторичной, третичной и четвертичной структуры белка называется денатурацией. Денатурация может быть вызвана термически (нагревание), химически, механически и т. д. При этом денатурация бывает обратимой и необратимой. Необратимой являются денатурация, связанная с разрушением первичной и вторичной структуры. После их разрушения белок самопроизвольно не восстанавливается. Например, гидролиз белков или варка яиц или мяса, взбивание яичного белка. Денатурация третичной и четвертичной структуры является обратимой. После их разрушения белки могут самопроизвольно восстанавливаться с возвращением биологических функций. Например, накручивание волос на бигуди (термическая денатурация) или химическая завивка.
Date: 2015-08-07; view: 865; Нарушение авторских прав