
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Карбонатна кислота та її похідні. Фосген, уретани, карбамінова кислота, хімічні властивості сечовини. Біурет, уреїди, уреїдокислоти
|
|
Угольная кислота НО-С(О)-ОH занимает особое место среди соединений углерода. Она не имеет гомологов, и любое замещение в ней ведет к получению функционального производного. Формально ее можно рассматривать одновременно как гидроксикислоту (гидроксимуравьиная) и двухосновную карбоновую кислоту. Угольная кислота и ее производные выполняют важные функции в организме, используются в синтетической практике, некоторые из них применяются в качестве лекарственных средств.
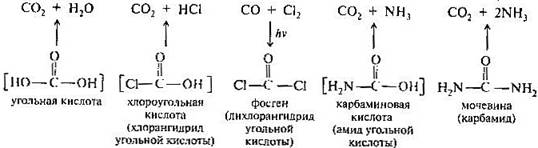
Угольная кислота как индивидуальное соединение существует только в водном растворе. Попытка выделить кислоту из раствора приводит к ее разложению на диоксид углерода и воду.
В водном растворе H2CO3 заметно диссоциирована. Угольная кислота и гидрокарбонат-ион НСО3- составляют буферную систему, играющую определяющую роль в поддержании постоянного значения концентрации ионов водорода в крови. Диоксид углерода (углекислый газ) СО2 — участник многих важных реакций‚ карбоксилирования и декарбоксилирования in vivo и in vitro. Карбоксилирование возможно в тех случаях, когда в реакцию с диоксидом углерода вступают соединения с частичным отрицательным зарядом на атоме углерода. Реакция диоксида углерода с ацилкоферментом А, приводящая in vivo к образованию малонилкофермента А. Подобно самой угольной кислоте, в свободном виде известны и некоторые ее производные: хлоругольная (хлоромуравьиная) кислота СlСООН и карбаминовая кислота (моноамид) Н2NСООН. Однако их сложные эфиры вполне стабильные соединения.
Для синтеза производных угольной кислоты может быть использован ее дихлорангидрид — фосген СОСl2, легко образующийся при взаимодействии монооксида углерода с хлором на свету. Фосген — чрезвычайно ядовитый газ. В первую мировую войну он применялся в качестве боевого отравляющего вещества. Некоторые эфиры хлоругольной кислоты, в частности бензиловый (карбобензоксихлорид) С6Н5-СН2-О-С(О)Сl и трет-бутиловый (третбутоксикарбонилхлорид) (СН3)3-С-О-С(О)Сl, широко применяются в синтезе пептидов. Этиловый эфир хлоромуравьиной кислоты при реакции с аммиаком образует этиловый эфир карбаминовой кислоты Н2N-СОО-С2Н5. Эфиры карбаминовой кислоты имеют общее название — уретаны.
Мочевина (карбамид) Н2N-С(О)-NН2 — диамид угольной кислоты — важнейший азотсодержащий конечный продукт обмена веществ у человека (с мочой выделяется около 20-30 г мочевины в сутки). В промышленности мочевину получают из аммиака и диоксида углерода при повышенном давлении и температуре (180— 230°С, 150—200 атм). Мочевина обладает основными свойствами и образует соли с одним эквивалентом кислоты (протонирование происходит по атому кислорода). Некоторые из солей, например оксалат и нитрат, плохо растворимы в воде. Кислоты и щелочи при нагревании вызывают гидролиз мочевины; ферментативно она гидролизуется под действием уреазы.
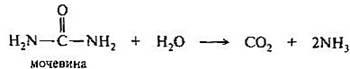
При медленном нагревании до температуры 150—160°С мочевина разлагается с выделением аммиака и образованием биурет.
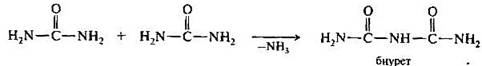
При взаимодействия биурета в щелочных растворах с ионами меди(II) наблюдается характерное фиолетовое окрашивание, обусловленное образованием хелатного комплекса (биуретовая реакция).
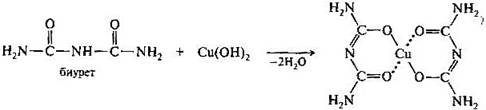
Остаток биурета в хелатном комплексе имеет имидную структуру. Важными производными карбоновых кислот, содержащими остаток мочевины в качестве заместителя, являются уреиды. По аналогии с амидами кислот и аминокислотами различают уреиды кислот и уреидокислоты.

Широкое распространение в качестве лекарственных средств, действующих на центральную нервную систему, получили циклические уреиды малоновой кислоты — барбитураты.
54. Будова і номенклатура 3-х, 4-х, 5-тичленних гетероциклів з одним гетероатомом. Хімічні властивості оксирану і азиридину.
Органические соединения, молекулы которых содержат циклы, включающие наряду с атомами углерода один или неск. атомов др. элементов (гетероатомов).
Наиб. значение имеют Т.е., в цикл к-рых входят атомы N, О, S. К ним относятся мн, алкалоиды, витамины, антибиотики, прир. пигменты; они входят в виде структурных фрагментов в молекулы нуклеиновых к-т, белков и др. Гетероциклические соединения-самый многочисленный класс орг. соед., включающий ок. 2/3 всех известных прир. и синтетич. орг. веществ.
Номенклатура. Согласно правилам номенклатуры ИЮПАК, для важнейших гетероциклических соединений сохраняются их тривиальные назв., напр. пиррол (ф-ла I), фуран (II), тиофен (III).
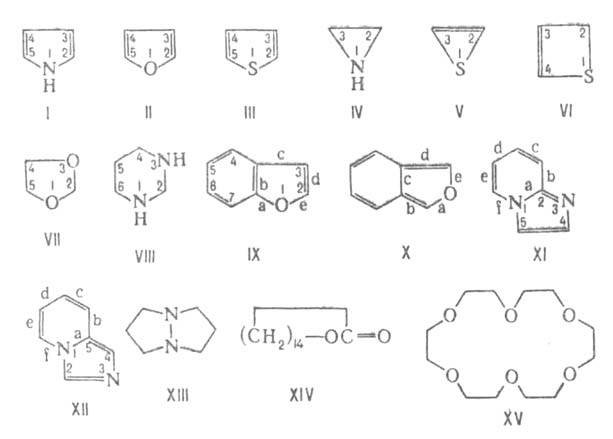
Систематич. назв. моноциклич. Т.е., содержащих в цикле от 3 до 10 атомов, образуют путем сочетания приставок, обозначающих гетероатомы (N-аза, О-окса, S-тиа, Р-фосфа и т. п.), с корнями, к-рые для основных гетероциклических соединений приведены в таблице.

Назв. насыщ. гетероциклов с числом атомов более 5 имеют те же корни, что и у ненасыщенных, но с добавлением приставки "пергидро".
Степень гидрогенизации ненасыщ. гетероцикла отражается в назв. с помощью корней или приставок "дигидро" (присоединены два атома водорода), "тетрагидро", "пергидро" и т.д.
Примеры систематич. назв.: азиридин (IV), тиирен (V), тает (VI), 1,3-диоксолан (VII), пергидропиримидин (VIII).
При построении назв. в-в, молекулы к-рых состоят из конденсиров. циклов, в кач-ве основы используют назв. "старшего" цикла. При этом учитывается, что гетероцикл всегда старше карбоцикла, а среди гетероциклов предпочтение отдается циклам с большим числом членов; при одинаковом размере двух циклов старшинство определяется природой гетероатома (N > О > S).
Связи в основном цикле обозначаются строчными латинскими буквами: а-связи 1-2, b-связи 2-3 и т.д. Напр., изомеры бензофурана наз. бензо[b]фуран (IX) и бензо[с]фуран (X). В случае конденсации с карбоциклом, имеющим неравноценные положения, напр. с нафталиновым ядром, или с др. гетероциклом связи "младшего" цикла нумеруются обычным образом, причем номера атомов "в месте конденсации" указываются в порядке, соответствующем последовательности связей основного цикла, напр. имидазо[1,2-а]пиридин (XI), имидазо[1,5-а]пиридин.
Окись этилена (этиленокси́д, оксира́н, 1,2-эпоксиэтан) —органическое вещество, имеющее формулу C2H4O. Этот бесцветный газ со сладковатым запахом является производнымэтилена и представляет собой простейший эпоксид — трёхчленный гетероцикл с одним атомом кислорода и двумя метиленовыми группами.
Благодаря особенностям молекулярной структуры, окись этилена вступает в реакции присоединения с раскрытием цикла, и таким образом легко подвергается полимеризации.
Вещество является чрезвычайно огне- и взрывоопасным. Окись этилена обладает дезинфицирующими свойствами, а также является сильным ядом для человека, проявляя канцерогенное,мутагенное, раздражающее и наркотическое действие.
Благодаря особенностям молекулярной структуры), окись этилена является весьма реакционноспособным соединением и легко вступает в реакции с различными соединениями с разрывом C-O связи и раскрытием цикла. Для соединения наиболее характерны реакции с нуклеофилами, проходящие по механизму SN2 как в кислой (слабые нуклеофилы: вода, спирты), так и щелочной среде (сильныенуклеофилы: OH−, RO−, NH3, RNH2, RR’NH и пр.)[12].
Реакции, катализируемые кислотами. Оксиран легко протонизируется за счет неподеленной пары электронов гетероатома. Образовавшийся протонированный оксиран гораздо легче подвергается действию нуклеофильных реагентов. Реакции взаимодействия оксирана с сильными циклеофилами (аммиак, амины, металлорганические соединения).
Оксиран с аммиаком в зависимости от соотношения реагентов образует МОНО-, ди- и триэтаноламины. Оксиран реагирует с алифатическими аминами с образованием N-алкиламиноэтанолов. Взаимодействие оксирана с реактивами Гриньяра. С магнийорганическими соединениями оксиран образуег продукты присоединения, легко гидролизующиеся до спиртов. Полимеризация оксирана. Возможна в присутствии сильных основании с образованием полиэтиленоксида (полиэтиленгликоля).
Азиридин (азациклопропан, этиленимин) — азотсодержащеегетероциклическое соединение. Относится к циклическим аминам.
Date: 2015-07-27; view: 1574; Нарушение авторских прав