
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Принципы классификации МЭС
|
|
1.2.1. Классификация материалов по типам химической связи
Рассмотрим 4 типа химической связи: ионную, ковалентную, металлическую и молекулярную (или связь Ван-дер-Ваальса). В зависимости от природы химической связи, посредством которой осуществляется взаимодействие между структурными единицами, принято различать следующие типы твердых веществ: ионные, ковалентные, металлические и твердые вещества с невалентными силами сцепления (ван-дер-ваальсово взимодействие и водородная связь). Естественно, что по этой классификации четкой границы между различными типами твердых веществ провести нельзя, так как нельзя четко разграничить различные типы связей.
Понятие «структура материала» очень широко используется в четырех основных аспектах и характеризует:
1) степень упорядоченности расположения микрочастиц;
2) особенности взаимного их расположения;
3) виды и концентрацию кристаллических дефектов;
4) состав и строение фаз.
1.2.2. Классификация материалов по степени упорядоченности структуры
По степени упорядоченности микрочастиц материалы делятся на кристаллические и некристаллические (аморфные), особое положение занимают поликристаллические материалы
Кристалл — твердое тело, имеющее трехмерное периодическое пространственное расположение микрочастиц и приобретающее вследствие этого при определенных условиях роста форму многогранника. Кристалл, как говорят, обладает дальним порядком.
Аморфные тела таким порядком не обладают, однако рассматривать их как полностью хаотические, бесструктурные по современным представлениям было бы неправильно, так как в них обнаружена упорядоченность, простирающаяся лишь на небольшие области — аморфные тела характеризуются ближним порядком.
Четкой границы между кристаллическими и аморфными телами провести не удается, поскольку между ближним и дальним порядками разница условна и определяется возможностями экспериментального метода, которым исследуется структура. Если, как это чаще всего бывает, используется рентгеноструктурный анализ, то разрешающая способность находится на уровне десятков нанометров. Поэтому нередко говорят — рентгеноаморфное вещество, имея в виду, что если в нем есть кристаллиты, то их размер меньше 102 нм.
Более чувствительным методом изучения степени упорядоченности является электронно-дифрактометрический. Его использование позволяет не только отнести вещество к кристаллическим или аморфным, но и выяснить многие детали кристаллической структуры, прежде всего определить зернистость структуры, то есть отличить монокристаллический материал от поликристаллического.
В технике монокристаллом называют единичный, относительно крупный кристалл с совершенной структурой, заданными свойствами, полученный искусственным путем. Свойства монокристаллов зависят в основном от природы материала— они предсказуемы и однозначны.
Подавляющее большинство традиционных природных и искусственных материалов имеет поликристаллическую структуру.
Поликристалл — совокупность неориентированных относительно друг друга зерен — кристаллитов. Кристаллиты, естественно, не являются монокристаллами, так как они не единичны, образуются в стесненных условиях, и их структура, как правило, сильно искажена.
Свойства поликристаллических тел во многом определяются границами зерен (рис. 1.1), площадь которых в единице объема может быть очень большой.
Границы зерен-кристаллитов представляют собой нарушение периодичности, сопровождающееся появлением так называемых «оборванных», ненасыщенных связей. Ясно, что электрон проводимости, взаимодействуя с ними, изменяет и скорость и траекторию, поэтому электропроводность поликристаллов заметно ниже, чем монокристаллов. Особенно велика эта разница в полупроводниках, связи в которых направленны, в металлах границы зерен проявляют себя главным образом вследствие концентрации на них примесей (межзеренная сегрегация).
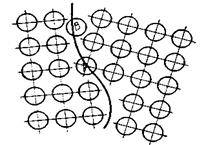
Рис. 1.1. Границы зерен в поликристаллическом материале
1.2.3. Строение идеальных кристаллов
В зависимости от природы химической связи, посредством которой осуществляется взаимодействие между структурными единицами, составляющими кристалл, принято различать следующие типы твердых веществ: ионные, ковалентные, металлические и твердые вещества с невалентными силами сцепления.
Ионные кристаллы - это сложные атомные кристаллы, представляющие собой соединения элементов с сильно различающейся электроотрицательностью. Преобладающим характером взаимодействия в таких веществах является электростатическое взаимодействие между заряженными ионами, его структурными единицами. Типичными представителями этого класса твердых веществ являются галогениды щелочных металлов, например NaCl, CsF и другие.
Образование ионных кристаллов можно представить следующим образом (рис.1.2). Атом галогена (F, Cl, Br, I), обладая большим сродством к электрону, захватывает валентный электрон щелочного металла (Li, K, Na и др.), имеющий малый ионизационный потенциал и при этом образуются отрицательно (анион) и положительно (катион) заряженные ионы. Даже грубые оценки показывают, что основная часть энергии связи в ионном кристалле обусловлена кулоновским (то-есть электростатическим) взаимодействием.
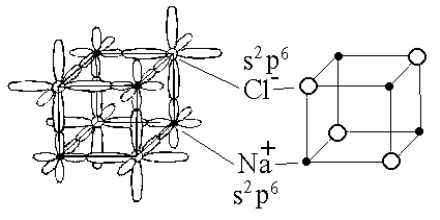 |
Рис. 1.2. Механизм образования остова ионных соединений со структурой NaCl
К ковалентным кристаллам относят атомные твердые тела, кристаллическая решетка которых образована посредством ковалентных связей между атомами. Типичными представителями ковалентных кристаллов являются алмаз, кристаллы кремния, германия, а также соединений типа AIIIBV и AIIBVI. В двух последних ковалентная связь является преобладающей, однако, в силу различной электроотрицательности элементов, имеются и дополнительные компоненты связи, например ионная. Типичным представителем такой структуры является алмаз, в котором атомы углерода связаны посредством четырех sp3- гибридных орбиталей и имеют тетраэдрическое окружение (рис 1.3.). В целом такая структура оказывается энергетически очень выгодной, что обеспечивает кристаллам высокую твердость и хрупкость.
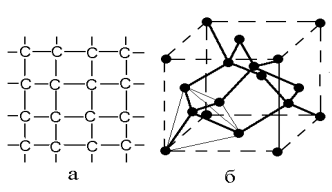 |
Рис.1.3. Схематическое изображение углеродных связей в алмазе (кремнии, германии) (а) и элементарная ячейка с выделенным тетраэдром (б)
Аналогичную структуру имеют кремний (Si), германий (Ge), серое олово, а также целый ряд полупроводниковых соединений типа AIIIBV (GaAs, InSb и др.) и AIIBVI (ZnS, ZnTe, СdTe и др.), которые так и называются алмазоподобными полупроводниками.
Типичным представителем твердых веществ с двухмерной ковалентной структурой является хорошо известная структура графита, в которой связь между атомами углерода образуется посредством трех sp2-гибридных орбиталей, лежащих в одной плоскости и образующих угол 120°. Слои связаны между собой уже только ван-дер-ваальсовым взаимодействием.
Одномерный ковалентный остов характерен для s и sp-связывающих орбиталей, когда образуется линейная или цепочечная структуры. Представителями таких твердых веществ являются, например сера, селен, теллур, в структуре которых цепи или кольца (характерные для серы) с ковалентной связью связаны между собой ван-дер-ваальсовым взаимодействием.
Металлические твердые тела, или просто металлы, в отличие от других веществ, обладают рядом характерных особенностей. Это - высокие электро- и теплопроводности, отражательная способность (блеск), пластичность (ковкость), и электроположительный характер химической связи. Перечисленные свойства, по существу, обусловлены наличием в металлах свободных электронов. Металлическая связь возникает при взаимодействии электроположительных элементов, внешние электроны которых имеют малую энергию ионизации. У каждого атома натрия (Na), например, восемь соседей и только один валентный электрон, который должен быть поделен с каждым из этих соседей. Поэтому в отличие от ковалентной связи, когда пара электронов локализуется между двумя атомами, в металлической связи электрон должен иметь равную вероятность нахождения у каждого из восьми ближайших соседей. В такой ситуации электроны могут свободно перемещаться от одного иона к другому, то есть в металле внешние валентные электроны атомов коллективизированы в пространстве между ионами металла и, таким образом, стягивают ионы в кристалл.
Свободные электроны металла определяют не только электрические и другие свойства, но и кристаллическую структуру. Металлы формируют относительно простые структуры: кубическую (объемно- и гранецентрированную) и гексагональную (рис. 1.4). Лишь небольшое число металлов имеет более сложные типы решеток.
В объемно-центрированную кубическую (ОЦК) структуру (рис. 1.4, а) кристаллизуются щелочные (литий, натрий, калий и др.), некоторые щелочно-земельные (барий, стронций и др.) металлы, а также молибден и тантал.
Гранецентрированную кубическую (ГЦК) (рис. 1.4, б) решетку имеют алюминий, железо, медь, серебро, золото, платина и другие металлы. Гексагональную плотнейшую упаковку (ГПУ) (рис. 1.4, в) формируют бериллий, магний, титан, кадмий, гафний и др.
Один и тот же элемент в зависимости от внешних условиях может кристаллизоваться в различных структурах. Это явление получило название полиморфизм. Практически все металлы обладают полиморфизмом.
К кристаллам с невалентными силами сцепления или молекулярным кристаллам относят твердые тела, остов которых построен из одинаковых молекул с насыщенными связями (H2, Cl2, Br2, I2, СО2 и др.), или атомов инертных газов (Ne, Ar, Xe и др.). Только жидкий гелий не может образовать кристалл даже при самых низких достижимых сейчас температурах. Гелий остается жидким даже вблизи абсолютного нуля, что вызвано особыми квантовыми свойствами жидкого гелия.
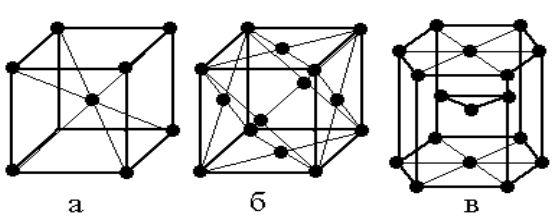 |
Рис. 1.4. Кристаллические решетки металлов: а – объемно-центрированная кубическая, б – гранецентрированная кубическая, в - гексагональная плотнейшая упаковка
Силы, удерживающие атомы или молекулы в кристаллическом состоянии, по своей природе уже не связаны с перераспределением электронов, поэтому их называют невалентные. Эти силы, известные как силы Ван-дер-Ваальса, очень малы и отвечающая им энергия взаимодействия составляет 0,02-0,15 эВ (для сравнения в NaCl она составляет около 8 эВ). Кроме того, как указывалось выше, в кристаллах слоистой или цепочечной структуры, внутри которой связи ковалентные, связь между слоями (или цепочками) осуществляется силами Ван-дер-Ваальса.
Вследствие ненаправленности и ненасыщенности ван-дер-ваальсовых сил, образующиеся кристаллы, как правило, имеют плотноупакованную структуру, аналогично ионным кристаллам. Например, йод и диоксид углерода кристаллизуется в деформированную вдоль оси молекулы ГЦК структуру (рис. 1.5, а).
Ленточные или цепочечные кристаллы, в которых цепи сформированы за счет ковалентных связей, координируются ван-дер-ваальсовыми силами. Так, кристаллический теллур (рис. 1.5, б) содержит цепочки -Те-Те-Те- и образует ромбоэдрическую элементарную ячейку. Такую же структуру имеет и кристаллический полиэтилен, ковалентные цепочки которого состоят из звеньев -СН2-. Хорошо известная структура графита (рис.1.5, в) формируется при ван-дер-ваальсовом взаимодействии плоских слоев углерода, внутри которых связь также ковалентная.
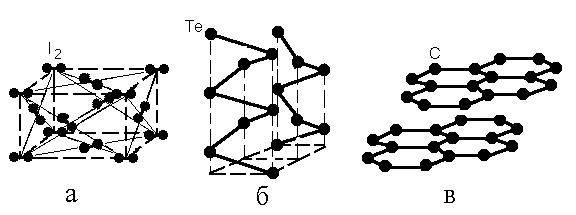 |
Рис. 1.5. Кристаллическая структура йода (а); теллура (б) и графита (в). Жирными линиями показаны ковалентные связи
Date: 2015-07-25; view: 1312; Нарушение авторских прав