
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Кондуктометрия
|
|
Кондуктометрические методы анализа просты, практически очень удобны и позволяют решить ряд задач, не поддающихся решению классическими химическими способами.
Все ранее рассмотренные методы анализа основаны на протекании электродных реакций либо в отсутствие внешнего тока (потенциометрия), либо под током (вольтамперметрия, кулонометрия, электрогравиметрия).
В кондуктометрии электродные реакции либо не протекают, либо являются вспомогательными и не учитываются. В кондуктометрии важнейшее значение приобретает такое свойство растворов электролитов, как электропроводность.
В качестве аналитических сигналов кондуктометрии могут быть использованы:
§ изменение сопротивления электролита;
§ изменение полного переходного сопротивления границы раздела фаз «электрод - электролит»;
§ общее изменение сопротивления электролитической ячейки.
В зависимости от используемого аналитического сигнала при проведении анализа различают собственно кондуктометрию, низкочастотную кондуктометрию и высокочастотную кондуктометрию.
Кондуктометрический анализ обычно проводят при использовании переменного электрического тока.
Электропроводность растворов электролитов является следствием диссоциации растворенного вещества и миграции ионов под действием электрического поля.
Как и все проводники электрического тока, растворы электролитов характеризуются определенным сопротивлением. Величина, обратная сопротивлению раствора называется электропроводностью среды:
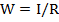
где, W - электропроводность раствора, 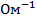 :
:
R - сопротивление раствора, Ом.
Сопротивление раствора электролита прямо пропорционально расстоянию l между погруженными в него электродами и обратно пропорционально их площади S:
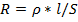 .
.
где, 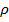 - удельное сопротивление;
- удельное сопротивление;
Величина, обратная удельному сопротивлению, называется удельной электропроводностью
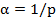 ,
, 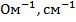
Удельная электропроводность - это электропроводность объема раствора, заключенного между параллельными электродами площадью 1 см2 каждый, находящимися на расстоянии 1 см друг от друга.
Электропроводность удобно относить к числу эквивалентов растворенного вещества. Поэтому введено понятие эквивалентной электропроводности.
Эквивалентной электропроводностью (l) называется электропроводность объема электролита, заключенного между параллельными электродами, расположенными на расстоянии 1 см друг от друга и имеющими такую площадь, чтобы между ними содержался 1 эквивалент вещества. Размерность эквивалентной электропроводности выражается 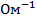 ,
, 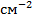 ,
, 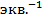 .
.
Удельная и эквивалентная электропроводность связаны между собой зависимостью:
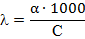
где, С - концентрация электролита, н.
Различают также электропроводность при бесконечно большом разбавлении 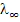 (иногда ее называют «предельная эквивалентная электропроводность»).
(иногда ее называют «предельная эквивалентная электропроводность»).
Она может быть представлена как сумма двух слагаемых, зависящих от природы катиона и аниона, которые входят в состав вещества:
 ,
,
где, 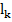 - подвижность катиона; (
- подвижность катиона; (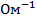 ,
, 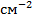 ,
, 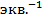 );
);
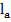 - подвижность аниона; (
- подвижность аниона; (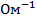 ,
, 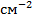 ,
, 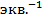 ).
).
Подвижность ионов представляет собой произведение абсолютной скорости движения ионов V на число Фарадея:
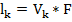 ;
; 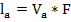 .
.
Т. к. В бесконечно разбавленных растворах при t = const., скорость движения ионов V = const., число Фарадея тоже const, то подвижность для каждого иона является величиной постоянной.
Подвижность, 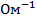 , , 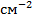 , , 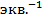 t = 25 t = 25 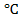
| |||
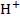
| 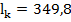
| 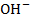
| 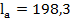
|
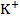
| 73,5 | 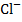
| 76,4 |
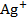
| 61,9 | 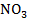
| 71,5 |
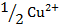
| 56,6 | ||
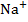
| 50,1 |
Растворы электролитов характеризуются степенью их диссоциации
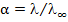
Чем сильнее диссоциирует ион, тем лучше его электропроводность и меньше его сопротивление.
Принимаем, что сильные электролиты диссоциируют нацело, поэтому
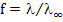
где, f- коэффициент электропроводности.
Зависимость электропроводности от концентрации.
При увеличении концентрации раствора электролита можно было бы ожидать, что удельная электропроводность будет возрастать, т. к. увеличивается число ионов.
Однако при достижении определенного max значения предельная электропроводность (α) начинает уменьшаться. Это связано с уменьшением расстояния между ионами и скорости их движения из-за усиления межионного взаимодействия, для слабых электролитов уменьшается их степень диссоциации.
Эквивалентная электропроводность (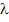 ) увеличивается с разбавлением и достигает max придельного значения при бесконечном разбавлении (с
) увеличивается с разбавлением и достигает max придельного значения при бесконечном разбавлении (с 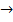 0). С разбавление ем ослабляются силы межионного взаимодействия и увеличиваются скорости движения ионов. Рис.
0). С разбавление ем ослабляются силы межионного взаимодействия и увеличиваются скорости движения ионов. Рис.
Зависимость электропроводности от природы электролита и природы растворителя.
Природа электролита оказывает заметное влияние на электропроводность, т. к. различные ионы движутся с разными скоростями. Аномально высокую подвижность имеют ионы 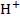 и
и 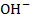 . Основными свойствами растворителя, влияющими на электропроводность, являются вязкость и диэлектрическая проницательность. Чем выше вязкость растворителя и меньше диэлектрическая проницательность, тем ниже электропроводность электролитов.
. Основными свойствами растворителя, влияющими на электропроводность, являются вязкость и диэлектрическая проницательность. Чем выше вязкость растворителя и меньше диэлектрическая проницательность, тем ниже электропроводность электролитов.
Влияние температуры на электропроводность.
Удельная и эквивалентная электропроводность повышаются с ростом температуры (т. к. увеличивается скорость ионов, снижается вязкость раствора, уменьшается гидратация ионов).
Повышение t на 1°С вызывает увеличение электропроводности на 2-2,5%.
Явления на электродах электролитической ячейки при прохождении синусои дального тока.
При пропускании через ячейку постоянного электрического ток, напряжение, приложенное к электродам будет складываться из разности потенциалов поляризованных катода и анода и падения напряжения в электролите.
В случае прохождения через ячейку переменного синусоидального тока неизменным остается лишь IR. Слагаемые, связанные с электродными реакциями претерпевают существенные изменения. На межфазной границе «Электрод раствор электролита», возникает двойной электрический слой, представляющий собой конденсатор, имеющий емкостное сопротивление, зависящее от частоты. Будут иметь место поляризационные явления (химическая, концентрационная, адсорбционная поляризация). Полное переходное сопротивление границы «электрод - электролит» называется импедансом и обозначается 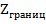 .
.
Полное сопротивление электролитической ячейки (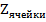 ) синусоидальному переменному току складывается из сопротивления раствора электролита (
) синусоидальному переменному току складывается из сопротивления раствора электролита (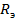 ) и импеданса (
) и импеданса (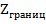 ).
).
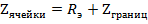
Сопротивление электролита 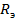 и импеданс
и импеданс 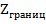 зависит от природы, состава раствора и частоты переменного тока совершенно по-разному. Следовательно, для методов физико - химического анализа возможно использовать либо измерение
зависит от природы, состава раствора и частоты переменного тока совершенно по-разному. Следовательно, для методов физико - химического анализа возможно использовать либо измерение 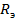 , либо
, либо 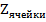 .
.
При увеличении частоты тока до 2000 - 4000 Гц сопротивление двойного эл. cлоя станет малым и на первый план выйдет сопротивление электролита 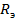 , по изменению которого можно проводить анализ (прямая кондуктометрия и кондуктометрическое титрование).
, по изменению которого можно проводить анализ (прямая кондуктометрия и кондуктометрическое титрование).
Для увеличения переходного сопротивления границы «электрод - электролит» (импеданса 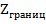 ) необходимо снизить частоту переменного тока до 7-50 Гц. Сопротивление раствора можно резко уменьшить добавкой фона (крепкой
) необходимо снизить частоту переменного тока до 7-50 Гц. Сопротивление раствора можно резко уменьшить добавкой фона (крепкой 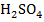 ). В результате получим случай низкочастотной кондуктометрии.
). В результате получим случай низкочастотной кондуктометрии.
Третий вариант - высокочастотная кондуктометрия, основанная на измерении полного сопротивления  при частоте переменного тока 1-30 МГц.
при частоте переменного тока 1-30 МГц.
Date: 2015-07-01; view: 889; Нарушение авторских прав