
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Спектральные методы анализа
|
|
Все химические соединения взаимодействуют с электромагнитными излучениями, уменьшая интенсивность (или мощность) потока излучения. Методы анализа основанные на взаимодействии вещества с электромагнитным излучением в широком интервале частот, начиная с у - лучей и кончая радиоволнами, являются важной областью аналитической химии.
Полный спектр электромагнитных волн.
| Излучение | 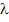 , см , см
| E, эВ | Процессы происходящие при излучении |
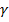 - лучи - лучи
| 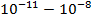
| 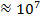
| Изменение в энергетическом состоянии ядер (спектроскопия -резонанса) |
| Рентгеновские лучи | 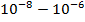
| 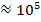
| Изменение в электронном состоянии внутренних электронов атомов (рентгено -спектроскопия) |
| Ультрофиолетовое и видимое | 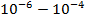
| 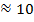
| Изменения в энергетическом состоянии внутренних электронов (электронные спектры) |
| Инфракрасное | 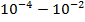
| 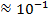
| Колебания в молекуле (колебательные спектры) |
| Радиоволны | 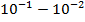
| 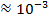
| Изменение энергетического состояния слинов электронов (спектроскопия ЭПР) |
| Радиоволны | 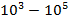
| 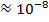
| Изменение энергетического состояния слинов ядер (спектроскопия ЯМР) |
Малекулярно - абсорбционный спектральный анализ
Молекулярно - абсорбционный спектральный анализ включает в себя спектрофотометрический и фотоколориметрический анализы.
Спектрофотометрический анализ основан на определении спектра поглощения или измерения светопоглощения при определенной длине волны, который соответствует максимуму кривой поглощения данного вещества.
Фотоколориметрический анализ основан на сравнении интенсивности цвета исследуемого окрашиваемого раствора и стандартно окрашиваемого раствора при определенной концентрации.
Происхождение молекулярных спектров поглощения.
Атомы или молекулы обладают ограниченным числом, дискретных или квантовых, уровней энергии, низшие из которых отвечают например 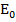 ,
, 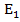 ,
, 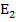 ,
, 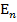 …
…
Если излучение определенной длины волны проходит через вещество не поглащаясь, это энергетическое состояние молекул этого вещества останется без изменения. Если же энергия поглощается, это молекулы вещества переходят из состояния с меньшей энергией 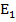 в состояние с большей энергией
в состояние с большей энергией 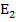 .
.
Согласно условию Бора, произведение волнового числа ϖ (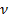 )поглощенного излучения и постоянной Планка h (
)поглощенного излучения и постоянной Планка h (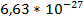 эрг.с) равно разности энергии молекул после поглощения и до него:
эрг.с) равно разности энергии молекул после поглощения и до него:
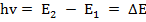
Если энергия конечного состояния выше, т. е. 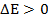 , то это соответствует поглощению излучения: если
, то это соответствует поглощению излучения: если 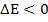 , то происходит излучение энергии. В первом случае мы получим спектр поглощения, а во втором - эмиссионный спектр.
, то происходит излучение энергии. В первом случае мы получим спектр поглощения, а во втором - эмиссионный спектр.
Электромагнитное излучение может быть охарактеризовано либо волновыми, либо энергетическими параметрами.
Волновой параметр может быть выражен длиной волны 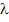 и частотой колебания v, которые связаны зависимостью:
и частотой колебания v, которые связаны зависимостью:
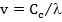 (1)
(1)
где, 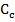 - скорость света.
- скорость света.
Часто пользуются обратным значением длины волны - волновым числом 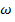 (v), измеряемым в
(v), измеряемым в 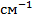 . Волновое число показывает, какое количество волн данной длины укладывается на протяжении 1см и определяется отношением:
. Волновое число показывает, какое количество волн данной длины укладывается на протяжении 1см и определяется отношением:
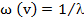 , или
, или 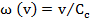 (2)
(2)
Поскольку величины h и 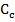 фундаментальные константы, то из соотношений (1) и (2) всегда можно произвести необходимый пересчет и определить волновое число, соответствующее определенной длине волны.
фундаментальные константы, то из соотношений (1) и (2) всегда можно произвести необходимый пересчет и определить волновое число, соответствующее определенной длине волны.
Например, 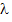 = 400 нм соответствует волновое число 25000
= 400 нм соответствует волновое число 25000 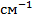 .
.
В абсорбционном анализе наиболее важное значение имеют электромагнитные колебания со следующими длинами волн:
а) «вакуумная ультрафиолетовая область спектра - спектр с длиной волн» 200нм (1 нм = 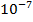 см = 1 ммк = 10 А);
см = 1 ммк = 10 А);
б) ультрафиолетовая область - спектр с длинами волн между 200 – 400 нм (200-300 нм называется дальней УФ областью, 300 – 400 нм - ближней);
в) видимая область спектра (длина волн 400 – 760 нм);
г) инфракрасная область спектра, находящаяся в пределах 760-20000нм.
В ИК области спектра единицей измерения длины волн служит микрон (1 мк - 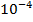 см).
см).
Законы поглощения света
Использование свойства окрашенных растворов поглощать световую энергию в практике колориметрического анализа базируется на законе Бугера - Ламберта - Бера, который является выражением двух самостоятельно сформированных законов.
Закон Бугера - Ламберта
Если световой поток 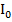 падает на кювету с раствором, то часть его отразится (I отр.), часть будет поглощена (
падает на кювету с раствором, то часть его отразится (I отр.), часть будет поглощена (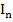 ) и часть пройдет через кювету (
) и часть пройдет через кювету (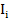 ). Т.к. Iотр. Небольшая величина, то Io=In+It
). Т.к. Iотр. Небольшая величина, то Io=In+It
В результате экспериментов Бугер (1729г.) и Ламберт (1760г.) сформулировали следующий закон «Слои вещества одинаковой толщины, при прочих равных условиях, всегда поглощают одну и туже часть падающего на них светового потока». Математическое выражение закона:
It=Io*e-k`*l
где, е - основание натурального логарифма;
k` -коэффициент погашения;
1 - толщина слоя.
Положив в основу десятичную систему логарифмов получим:
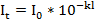
где 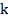 - коэффициент погашения,
- коэффициент погашения,
Коэффициент погашения численно равен обратной величине толщины слоя раствора в сантиметрах, ослабляющего интенсивность проходящего через него светового потока в 10 раз.
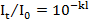 ; kl = 1; k = 1/l
; kl = 1; k = 1/l
Т. о. поглощающая способность любого раствора может быть охарактеризована значением k.
Коэффициент погашения к зависит от природы растворенного вещества и длины волны падающего света. Следовательно, первый закон поглощения справедлив только для монохроматического света, т. е. cвета определенной длины волны.
Из закона Бугера - Ламберта следует, что:
■ отношение светового потока прошедшего через слой раствора, к интенсивности падающего светового потока не зависит от абсолютной величины падающего потока;
■ если толщина слоя раствора увеличивается в арифметической прогрессии, то интенсивность светового потока, прошедшего через него, уменьшается в геометрической прогрессии.
Закон Бера. Второй закон светового поглощения был установлен в 1852г.:
Коэффициент поглощения К пропорционален концентрациям поглощающего вещества, т. е.
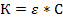
где, 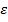 - коэффициент не зависящий от концентрации,
- коэффициент не зависящий от концентрации,
С - концентрация вещества.
Если С выражается в г.моль/л, а толщина поглощения слоя 1 - в см., то коэффициент 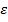 называется малярным коэффициентом погашения (экстенции).
называется малярным коэффициентом погашения (экстенции). 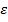 представляет собой постоянную величину, зависящую от длины волны падающего света, природы растворенного вещества, природы растворителя, температуры раствора и соответствует погашению раствора анализируемого вещества.
представляет собой постоянную величину, зависящую от длины волны падающего света, природы растворенного вещества, природы растворителя, температуры раствора и соответствует погашению раствора анализируемого вещества.
Закон Бера рассматривает изменение поглощения светового потока слоем постоянной толщины при изменении концентрации, а закон Бугера - Ламберта - изменение поглощения светового потока раствором постоянной концентрации при изменении толщины поглощающего слоя.
Объединяя эти законы (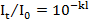 и
и 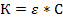 ) получим:
) получим:
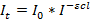
Отношение интенсивности светового потока, прошедшего через It, к интенсивности падающего светового потока I носит название прозрачного или пропускания Т:
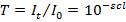
Величина Т, отнесенная к толщине слоя в 1 см, называется коэффициентом пропускания.
Логарифм величины, обратной пропусканию, носит название погашения (экс- тинкции) (Е), или оптической плотности (D):
E=D=lg1/Т= lg*Io/It= 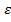 *c*l
*c*l
Т. о. Оптическая плотность D прямопропорциональна концентрации вещества в растворе. Если зависимость D от с изобразить графически, то получим прямую, идущую от начала координат. Если исследуемый раствор не подчиняется этому закону, то прямолинейность нарушается на каком-то участке или на всей кривой.
Причинами отклонения от закона Б-Л-Б является:
1. влияние посторонних электролитов;
2. диссоциация окрашенных соединений в растворах, причем окраска иона отличается от окраски молекулы;
3. влияние pH среды на окраску раствора (pH среды имеет очень большое значение при колориметрировании);
4. комплекснообразование;
5. изменение окраски раствора во времени;
6. зависимость интенсивности окраски от температуры (следует поддерживать температуру ± 1-3° С);
7. зависимость образования окрашенного соединения от количества, порядка добавления и концентрации реактива.
Классификация методов Фотометрического анализа
Фотометрический метод количественного анализа основан на переведении определенного компонента в соединение, способное поглощать свет.
Для определения неорганических компонентов чаще всего используют реакции образования окрашенных комплексных соединений, имеющих характерные полосы поглощения в видимой, УФ или ИК областях спектра.
Для органических компонентов чаще всего используют реакции синтезы окрашенных соединений. Т.о. центральное место в фотометрическом анализе занимает химическая реакция.
Различают три группы способов измерения концентрации окрашенного соединения в растворе:
1. Визуальное сравнение. Визуально можно довольно хорошо установить равенство интенсивности окрасок или цвета двух растворов. Такой способ называется колориметрическим анализом.
2. поглощение света измеряется при помощи приборов с фотоэлементом. Такие приборы называют фотоэлектроколориметрами (ФЭК), а способ называется фотоколо - метрическим анализом.
3. наиболее совершенным прибором является спектрофотометр, который позволяет выделить узкий участок спектра, а именно тот, с которым оптически реагирует окрашенное вещество. Измерение поглощения света спектрофотометром называется спектрофотометрическим анализом.
Методы измерения оптической плотности раствора
Фотометрические методы определения D, применяются шире визуальных. Определение концентрации методом сравнения оптических плотностей эталонного и исследуемого растворов.
Готовят эталонный раствор определяемого вещества известной концентрации. Определяют 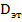 . этого раствора при эталонной длине волны. Затем определяют Dx исследуемого раствора при той же длине волны и той же толщине слоя.
. этого раствора при эталонной длине волны. Затем определяют Dx исследуемого раствора при той же длине волны и той же толщине слоя.
Для эталонного раствора имеем:
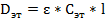
Для исследуемого раствора имеем:
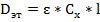 отсюда
отсюда 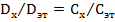 ,
, 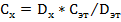
Количество (q) мт определяемого вещества с учетом разбавления раствора находим:
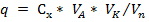
где, 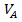 - объем окрашенного раствора, мл.
- объем окрашенного раствора, мл.
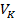 - общий объем используемого раствора, мл.
- общий объем используемого раствора, мл.
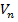 - объем аликвотной части исследуемого раствора, взятой для приготовления окрашенного раствора, мл.
- объем аликвотной части исследуемого раствора, взятой для приготовления окрашенного раствора, мл.
Определение концентрации вещества в растворе по значению молярного коэффициента поглощения
Готовят эталонный раствор исследуемого вещества концентрации 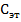 (моль/л) и измеряют
(моль/л) и измеряют 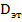 этого раствора при длине волны l. Значение
этого раствора при длине волны l. Значение 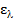 вычисляют по формуле:
вычисляют по формуле:
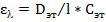
Затем определив значение Dx при той же длине волны и зная 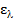 , находим
, находим 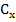 (моль/л):
(моль/л):
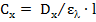 , моль/л
, моль/л
Количество q, мг находим по формуле:
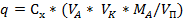
где, 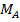 - молярная (атомная) масса определяемого вещества (иона)
- молярная (атомная) масса определяемого вещества (иона)
Определение концентрации вещества с помощью калибровочного графика
Функциональная зависимость D=f(c) между оптической плотностью раствора и концентраций поглощающего вещества может быть установлена графически. Для этого готовят серию эталонных растворов определяемого вещества различной концентрации. Определяют оптические плотности и по полученным данным стоят график. Определив оптическую плотность исследуемого раствора при той же дине волны и толщине слоя, находим концентрацию исследуемого вещества по графику.
рисунок
Количество вещества q, мг. Определяют по формуле
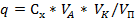 , мг
, мг
Спектрофотометрическое титрование
Оптические методы могут служить не только для непосредственного определения концентрации вещества, но и для определения точки эквивалентности в процессе титрования при условии, что существует линейная зависимость между величинами светопоглощения и концентрацией вещества в исследуемом растворе. В процессе титрования отличают значение оптической плотности и строят кривую в координатах D - V.
При прохождении света через дисперсные системы наблюдается рассеивание или поглощение света твердыми взвешенными частицами. Это явление положено в основу нефелометрии и турбидиметрии.
При нефелометрическом анализе замеряется интенсивность рассеянного света раствором анализируемого вещества
I=lo*k*N
где, N- число частиц взвеси
Интенсивность рассеянного потока прямо пропорционально концентрации частиц, находящихся в растворе:
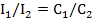
Это уравнение лежит в основе нефелометрических измерений интенсивности рассеянного света в двух растворах с частицами одинаковой формы и размеров соотносятся между собой, как концентрации частиц определяемого вещества.
Турбидиметрический метод основан на измерении проходящего через раствор светового потока который уменьшается за счет поглощения и рассеяния света взвешенными частицами:
lgIo/I = k*c*l или D=k*c*l
где, k - молярный коэффициент мутности раствора.
Аппаратура. Основные узлы приборов для абсорбционных измерений
Независимо от области спектра приборы для измерения пропускания или поглощения растворов состоят из 5-ти основных узлов:
■ стабильного источника излучения энергии;
■ устройства, позволяющего выделить ограниченную область длин волн;
■ прозрачных кювет для пробы и растворителя;
■ дитектора или преобразователя, который превращает энергию излучения в измеряемый сигнал, обычно электрический;
■ индикатора сигнала.
На схеме показан порядок расположения этих узлов.
Схема
Индикатор сигналов большинства абсорбционных приборов снабжен шкалой с делениями от 0 до 100 линейных единиц. Шкала непосредственно указывает, пропускание в % при предварительной настройке индикатора на нуль с закрытой шторкой, не позволяющей излучению попадать на детектор. Помещая на пути светового потока холостой раствор индикатор настраивают на назначение 100. Этого добиваются варьированием интенсивности источника или усилением сигнала детектора. Если на пути потока поместить кювету с испытываемым раствором, индикатор укажет пропускание в %. Индикатор можно снабдить логарифмической шкалой, непосредственно указывающей оптическую плотность D. Сложность отдельных узлов абсорбционных приборов зависит от охватываемого интервала длин волн и области использования данных. Однако, независимо от степени сложности прибора функции каждого узла сохраняются.
Для измерения поглощения в видимой области существует 3 типа приборов: колориметры, фотометры и спектрофотометры. Измерение поглощения в ультрафиолетовой и инфракрасной областях выполняются на спектрофотометрах (в большинстве случаев).
Колориметры. В колориметрах детектором служит глаз, а преобразователем и детектором сигнала 1 мозг человека. Однако глаз и мозг способны лишь сравнивать окраску, поэтому в колориметрическом методе требуется один или несколько эталонов. Простейшие метод заключаются в сравнении пробы с серией эталонов. Для этой цели часто применяют колориметрические приборы Несслера, прокалиброванные таким образом, что толщина слоя в них одинакова (во всех). Источником излучения служит дневной свет.
Метод прост, но имеет ряд недостатков:
■ всегда необходимы эталоны;
■ визуально невозможно сравнить интенсивность в присутствии другого окрашенного вещества в растворе;
■ человеческий глаз не столь чувствителен к небольшим изменениям оптической плотности, поэтому невозможно обнаружить разницу в концентрации менее 5 %.
Визуальные методы находят широкое применение для серийных анализов (наборы для определения pH). Есть индикаторные наборы для определения хлора в воде, анализа почв.
Фотометры. Фотометры представляют собой простой и сравнительно недорогой прибор для выполнения анализа абсорбционным методом. Удобство, простота в устройстве и обращении - качества, которых недостает более сложным спектрофотометрам. Обычный фотометр имеет все узлы, о которых мы уже говорили. В качестве источника излучения в фотометрах для получения видимого излучения используется нить вольфрамовой лампы. Рабочая температура нити достигает 2870 К. Такие лампы используют в интервале длин волн 320-2500 нм.
Регулирование длины волны. В фотометрах (и спектрофотометрах) имеются устройства, которые выделяют область длин волн, необходимых для данного анализа. Такие устройства делятся на две категории:
Светофильтры, используемые в фотометрах, поглощают большую часть спектра и пропускают относительно ограниченный участок длин волн.
Монохроматоры, используемые обычно в спектрофотометрах - более сложные устройства, позволяющие непрерывно менять длину волны.
Используются следующие виды светофильтров:
■ абсорбционные светофильтры;
■ светофильтры с ограниченной полосой пропускания;
■ интерференционные светофильтры.
Последние обладают более узкой полосой пропускания, т.е. большей способностью выделения желаемой длины волны чем абсорбционные СФ. Выпускаются интерференционные СФ с полосами пропускания в интервале от УФ - области до примерно 6 мкм в ИК - области.
Ячейки или кюветы, используемые для фотометрических измерений, изготавливают обычно из стекла, хотя имеют применение и прозрачные пластиковые кюветы.
Обычно используются парные калиброванные кюветы. Толщина слоя при измерениях в видимой области спектра равна 1 см. Изготавливают также кюветы длиной от 0,1 см (и менее) до 10 см.
Достоверность измерений сильно зависит от правильного обращения с кюветами. Отпечатки пальцев, жир и др. загрязнения заметно влияют на пропускающую способность. Обязательна тщательная очистка кювет до и после анализа, при этом не следует касаться пальцами поверхностей граней. Кюветы следует систематически калибровать относительно друг друга с помощью поглощающего раствора.
Детекторы излучения - фотоэлектические устройства, предназначенные для превращения излучательной энергии в электрическую. В качестве детекторов излучения используются фотоэлементы и фотоумножители.
Спекторофотометры. В отличии от фотометров монохроматоры в спектрофотометрах служит призма или дифракционная решетка, позволяющая непрерывно менять длину волны. Существуют приборы для измерений в видимой, УФ и ИК - областях спектра. Принципиальная схема спектрофотометра практически не зависит от спектральной области и приведена на рисунке.
Рисунок
Date: 2015-07-01; view: 1105; Нарушение авторских прав