
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Электрохимические методы анализа
|
|
Электрохимические методы анализа основаны на электрохимических процессах, протекающих в электролитической ячейке, которая представляет собой систему, состоящую из электродов, помещенных в растворы электролитов. В простейшем случае - из 2-х металлических электродов, опущенных в раствор электролита.
В зависимости от происходящих в ней процессов, электролит - ячейка может являться либо электрохимическим, либо гальваническим элементом.
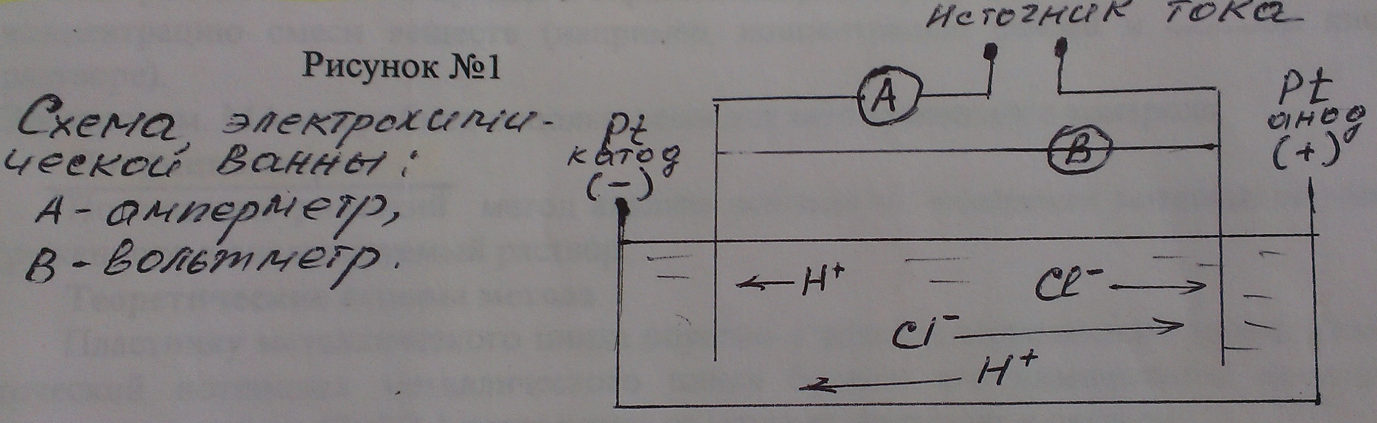
Электрохимической ванной называется система, в которой за счет приложенного извне э лектрического тока происходит химические превращения на электродах. Например, два платиновых электрода опущены в стеклянную емкость с 0,1М водным раствором HCl. К электродам подведен постоянный ток необходимого напряжения (рис. 1). HCl в водном растворе диссоциирует, к отрицательному электроду (катоду) будут двигаться 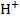 к положительно заряженному (аноду) - ионы
к положительно заряженному (аноду) - ионы 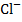 .
.
Если приложенное извне напряжение постоянного тока обеспечивает достижение потенциалов р азряда ионов 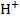 и
и 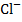 , то на электродах будут проходить следующие реакции:
, то на электродах будут проходить следующие реакции:
катод: 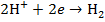
анод: 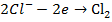
Т. о. в данной электролитической ячейке, являющейся электрохимической ванной, прохождение электрического тока обеспечивается двумя видами электрической проводимости:
металлической проводимостью проводников первого рода (платина, Ag, Сu, Аl) в которых электрический ток представляет собой поток электронов, передвигающихся от (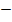 ) полюса к (
) полюса к (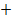 );
);
электролитической проводимостью проводников второго рода (растворы электролитов), когда электрический ток проходит через раствор электролита за счет движения находящихся в нем ионов.
Через границу раздела фаз «металл - раствор электролита» электрический ток проходит за счет электродных реакций на катоде и аноде.
Аналогичное прохождение электрического тока наблюдается и в гальваническом элементе. Гальванический элемент является системой, в которой за счет химических превращений веществ на электродах электролитической ячейки во внешней цепи возникает электрический ток.
Электрические параметры электролитической ячейки (сила тока, напряжений, сопротивление и т.д.) могут служить аналитическими сигналами при проведении анализов, если эти сигналы будут измерены с достаточной точностью. Поэтому электрохимические методы анализа основаны на зависимости электрических параметров от концентрации, природы и структуры вещества.
Электрохимические методы анализа используют либо для прямых измерений, основанных на зависимости «аналитический сигнал - состав», либо для определения конечной точки титрования.
Электрохимические методы анализа можно классифицировать следующим образом:
· методы, в которых отсутствует протекание электродных реакций, т.е. строение двойного электрического слоя в расчет не принимается (например, кондуктометрия);
· методы, основанные на электродных реакциях в отсутствие внешнего тока (потенциометрия) или под током (вольтамперометрия, кулономегрия).
Электрохимические методы позволяют определить:
■ концентрацию веществ в широком интервале (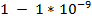 мг/л)
мг/л)
■ концентрацию веществ в мутных и окрашенных растворах;
■ концентрацию смеси веществ (например, концентрацию слабой и сильной кислот в растворе).
Электрохим. МА могут быть использованы для автоматического контроля.
Потенциометрия
Потенциометрический метод анализа основан на измерении потенциала электрода, погруженного в анализируемый раствор.
Теоретические основы метода
Пластинку металлического цинка опустим в раствор сернокислого цинка. Поскольку химический потенциал металлического цинка больше его химического потенциала в растворе электролита (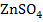 ) ионы цинка из металла переходят в раствор.
) ионы цинка из металла переходят в раствор.
Вследствие этого на поверхности металлического цинка скапливаются электроны, и она заражается отрицательно.
В результате ионы Zn+2 не дифундируют в глубину раствора, а скапливаются у металлической поверхности:
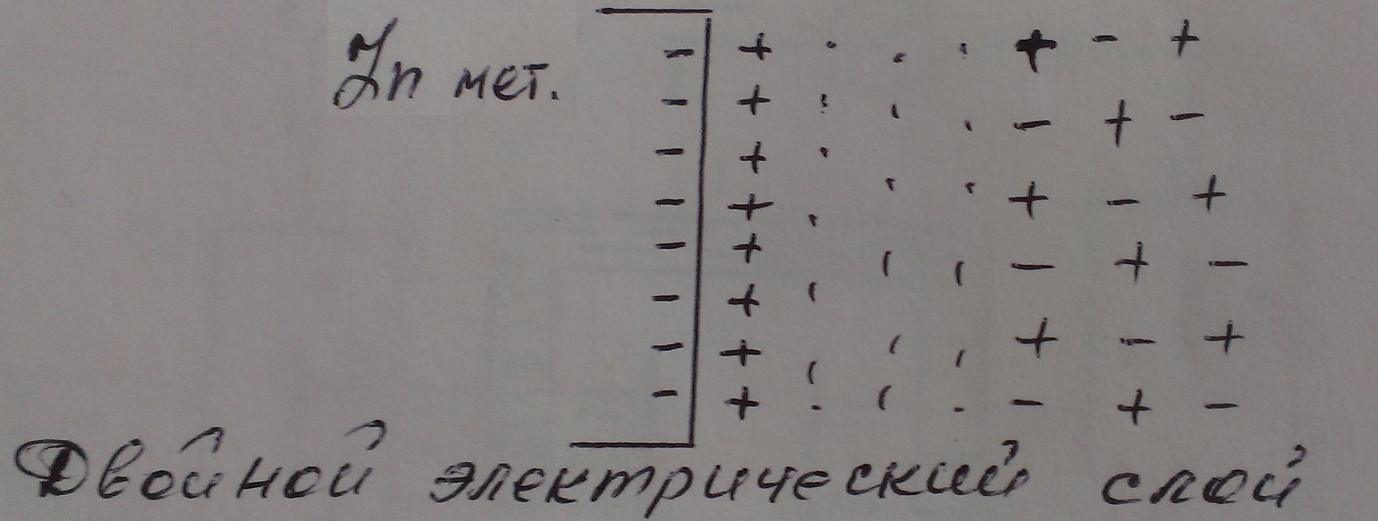
Рисунок 2 – Двойной электрический слой
В конечном итоге достигается динамическое равновесие - сколько ионов перешло в раствор, столько же вернулось из раствора в металл.
Таким образом, поверхность металла приобретает отрицательный заряд, а прилегающий к ней слой электролита - положительный. В результате образуется двойной электрический слой, который представляет собой конденсатор с плоскопараллельными обкладками. Из электротехники известно, что если обкладки плоскопараллельного конденсатора заряжены равномерно (+ и -), то между ними возникает скачек потенциала, который называется равновесным электродным потенциалом и обозначается 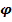 .
.
В рассмотренном случае равновесный потенциал
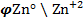
Аналогичные процессы происходят и при использовании металлической пластины Сu, опущенной в раствор 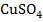 . Разница состоит лишь в том, что поверхность металлической Си заряжен положительно, а прилегающий слой электролита - отрицательно.
. Разница состоит лишь в том, что поверхность металлической Си заряжен положительно, а прилегающий слой электролита - отрицательно.
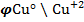
Ясно, что равновесные электродные потенциалы могут отличаться не только по величине, но и по знак.
От электродных потенциалов перейдем к гальваническим элементам (рис. 3). Соединим емкости с растворами 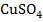 и
и 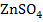 электролитическим ключом (1), представляющим собой загнутую (П - образную) стеклянную трубку, заполненную хорошо проводящим электролитом, например КCl. Металлические электроды соединим проводами, присоединив к ним амперметр (3).
электролитическим ключом (1), представляющим собой загнутую (П - образную) стеклянную трубку, заполненную хорошо проводящим электролитом, например КCl. Металлические электроды соединим проводами, присоединив к ним амперметр (3).
При замыкании контакта (2) амперметр покажет наличие тока в цепи, т.к. два электрода имеют разные потенциалы, а это ведет к возникновению ЭДС.
Мы получаем гальванический элемент Якоби-Даниэля. Он состоит из 2-х полуэлементов, электролитического ключа и внешней цепи. Подобная система называется гальваническим элементом с переносом.
Если два разных электрода опущены в один раствор, следовательно, электролитический ключ отсутствует, такая система называется гальваническим элементом без переноса.
Поскольку гальванический элемент есть система, обратная электрохимической ванне, катод в нем имеет (+), а анод (-). На аноде идет растворение цинка:
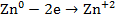
на катоде – осаждение меди
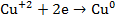
Суммарная химическая реакция имеет вид
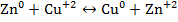
Гальванические элементы бывают:
■ химические (в которых природа электродов и электролитов разная) и концентрационные (типичный пример - элемент Якоби - Даниэля)
■ концентрационные, в которых электроды и электролиты одни и те же, но концентрация в полуэлементах различная.
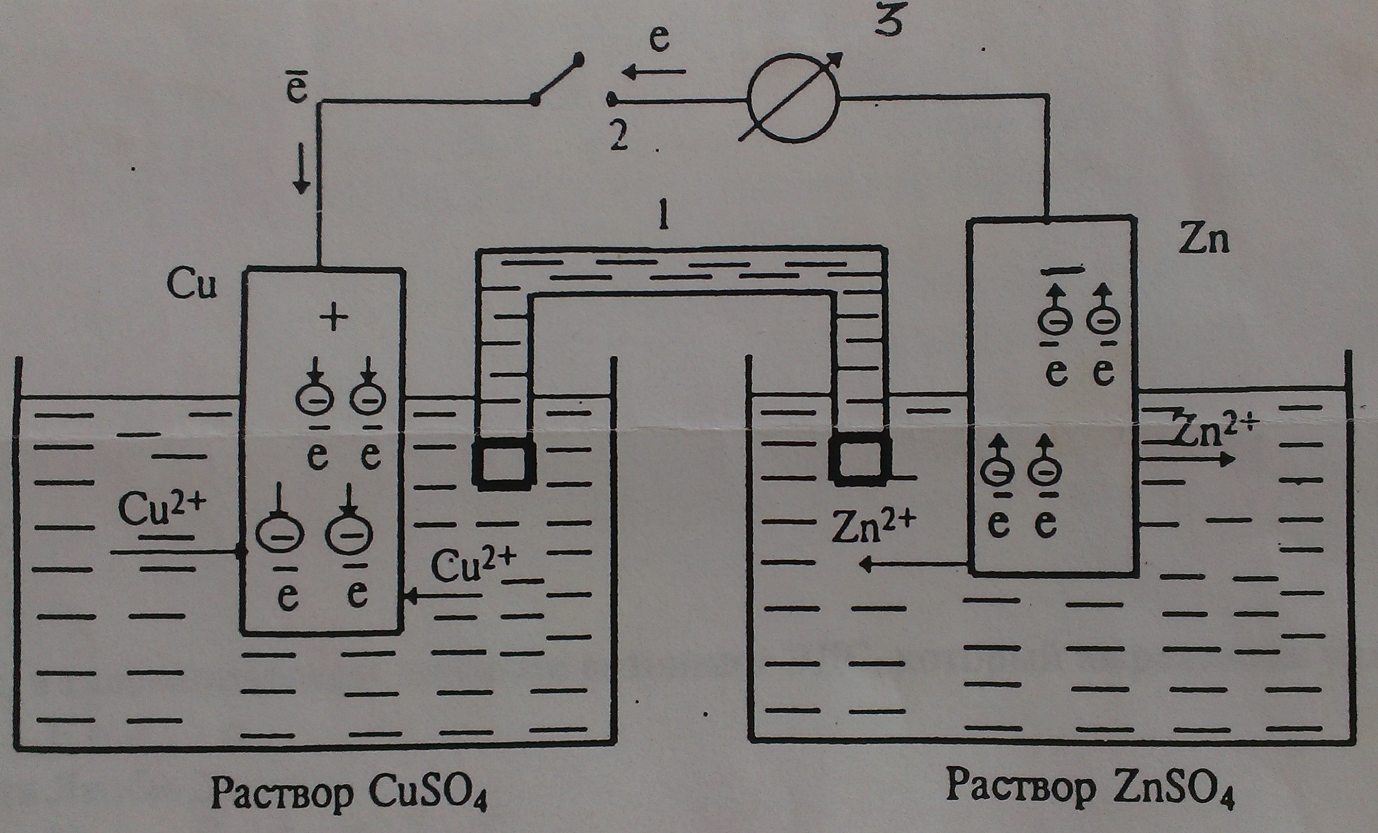
Рисунок 3 – Гальванический элемент
Итак, в гальваническом элементе возникает ЭДС, который выражается уравнением:
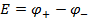
Для элемента Якоби-Даниэля
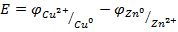
(разность равновесных потенциалов медного и цинкового электродов, опущенных в растворы их солей).
Равновесный потенциал электрода зависит от измерения активности ионов, которыми этот электрод обменивается с электролитом:
Уравнение Нернста
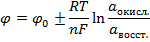
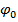 - стандартный потенциал электрода (при 25°С, 1 атм. и активности потенциалопределяющих ионов = 1). Для каждого металла
- стандартный потенциал электрода (при 25°С, 1 атм. и активности потенциалопределяющих ионов = 1). Для каждого металла 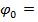 const;
const;
R - универсальная газовая постоянная (8,314 Дж./К * моль);
Т - температура (К);
n - валентность иона;
F - постоянная Фарадея (96496 кулонов);
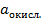 - активность ионов в окисленной форме;
- активность ионов в окисленной форме;
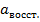 - активность ионов в восстан. форме.
- активность ионов в восстан. форме.
Уравнение (формула) Нернста дает зависимость величины равновесного потенциала от концентрации ионов в растворе электролита.
Активность электролита связана с концентрацией уравнением
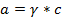
а - активность ионов электролита;
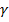 - коэффициент активности;
- коэффициент активности;
с - концентрация ионов электролита;
Следовательно уравнение Нернста будет иметь следующее выражение:
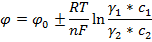
Исходя из последнего уравнения можно объяснить возникновение ЭДС и в концентрационном гальваническом элементе.
В последнем электроды и электролиты одни и те же, но концентрации электролитов разные, следовательно, в соответствии с уравнением Нернста потенциалы электродов будут разные и в электрической цепи возникнет ЭДС.
Концентрационный гальванический элемент будет работать до тех пор, пока концентрации у полуэлементов станут равными. Тогда ЭДС = 0.
В потенциометрии используют гальванические элементы с переносом и без переноса. При этом применяют два типа электродов: индикаторные электроды и электроды
Индикаторным электродом называется электрод, чей потенциал в соответствии с уравнением Нернста. зависит от изменения концентрации ионов, которыми обменивается электрод с раствором.
Электродом сравнения называется такой электрод, чей потенциал не зависит от природы и концентрации растворов, т. е. потенциал электрода сравнения остается одним и тем же в разных растворах различной концентрации.
Индикаторные электроды бывают двух типов - металлические и мембранные. Металлическими называются электроды, у которых на границе раздела фаз «металл — раствор электролита» протекают реакции с участием электронов. В качестве металлических электродов используют платину, серебро, медь, кадмий, свинец, т. е. металлы, которые способны давать обратимые полуреакции. Их потенциалы воспроизводимы и полностью отражают активность их ионов в растворе.
Мембранными или ионоселективными, называются электроды, у которых на границе раздела фаз «электрод - раствор электролита» протекают ионообменные реакции. Ионоселективные электроды делятся на 4 - группы:
1) Стеклянные электроды;
2) Электроды с твердыми мембранами;
3) Электроды с жидкой мембраной;
4) Электроды с газовыми мембранами.
Среди ионоселективных электродов наибольшее распространение получил стеклянный электрод, предназначенный для определения pH.
1) стеклянный электрод устроен следующим образом (рис.4):
| Рисунок 4 |
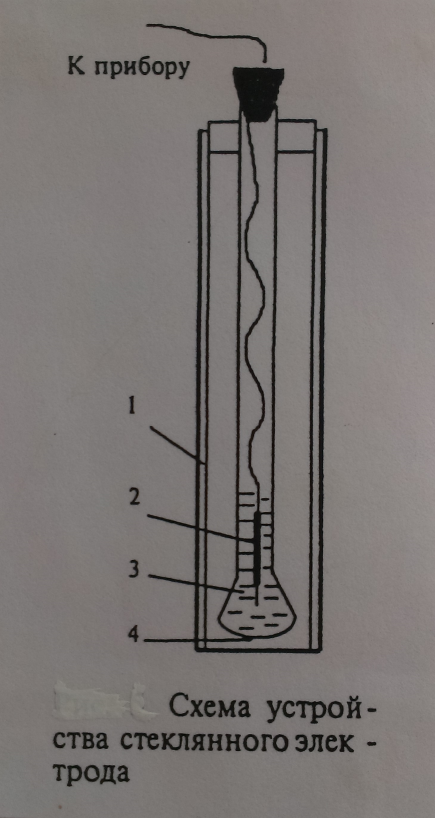 К концу толстостенной стеклянной трубки припаян толстостенный шарик (4), изготовленный из специального pH - чувствительного стекла. Внутрь шарика заливается 0,1 м раствор НСl (3), насыщенный AgCl. В раствор погружают серебряную проволоку, покрытую хлоридом серебра, которая и является токоотводом (2).
К концу толстостенной стеклянной трубки припаян толстостенный шарик (4), изготовленный из специального pH - чувствительного стекла. Внутрь шарика заливается 0,1 м раствор НСl (3), насыщенный AgCl. В раствор погружают серебряную проволоку, покрытую хлоридом серебра, которая и является токоотводом (2).
Это устройство закрывается защитной трубкой (1).
Мембраной является толстостенный шарик (4), изготовленный из специального стекла (сод. 22% 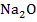 ).
).
Перед началом работы стеклянный электрод замачивают 8 часов в 0,1 м НСl (иначе он не будет селективен по отношению к ионам 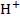 ). При этом ионы
). При этом ионы 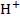 из раствора обмениваются на ионы Na из стеклянной мембраны, и в системе устанавливается равновесие. Изменение pH раствора сдвинет равновесие и потенциал изменится.
из раствора обмениваются на ионы Na из стеклянной мембраны, и в системе устанавливается равновесие. Изменение pH раствора сдвинет равновесие и потенциал изменится.
2) 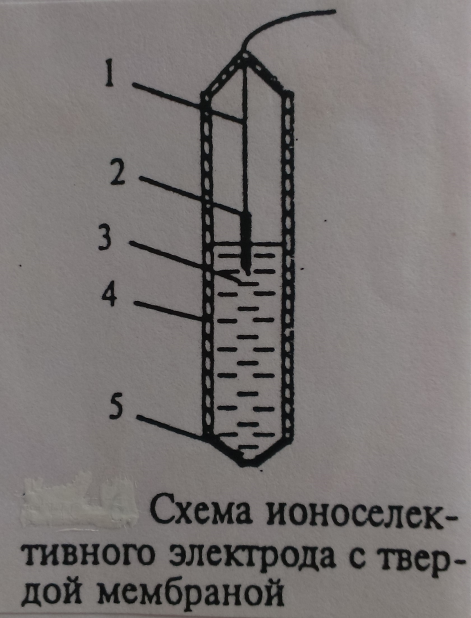 электроды с твёрдыми мембранами могут применятся для определения ионов в растворе (
электроды с твёрдыми мембранами могут применятся для определения ионов в растворе (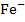 ,
, 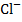 ,
, 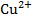 ). В качестве твердых мембран могут использоваться такие соединения, как
). В качестве твердых мембран могут использоваться такие соединения, как 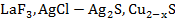 .
.
Ионоселективный электрод с твердой мембраной (риc.5) состоит из мембраны (5), корпуса (4), внутреннего раствора определяемого иона и хлорида калия (0,1 М КСl) (3) внутреннего полуэлемента Ag/AgCl (2), места припоя провода (1).
Применение электродов с жидкими мембранами основано на том, что на границе раздела фаз между анализируемым раствором и не смешивающейся с ним жидкостью возникает потенциал, обусловленный ионным обменом между двумя этими жидкостями.
| Рисунок 5 |
Большое распространение получили плёночные пластифицированные электроды. Чувствительный элемент таких электродов состоит из электродно активного компонента, поливинилхлорида и растворителя (пластификатора). Конструкция такого электрода аналогична конструкции электрода с твердой мембраной, только вместо последней в корпус вклеена пластифицированная мембрана, а в корпус электрода залит раствор сравнения. Токоотводом служит хлорсеребряный электрод.
Ионоселекгивные э лектроды широко используются по и анализе природных и сточных вод. т.к. позволяют определить отдельные ионы в сложной смеси.
Электроды сравнения
При проведении потенциометрического анализа, основанного на измерении ЭДС гальванического элемента, необходим полуэлемент, потенциал которого был бы известен, постоянен и совершенно не зависел от исследуемого раствора. Такой полуэлемент называется электродом сравнения.
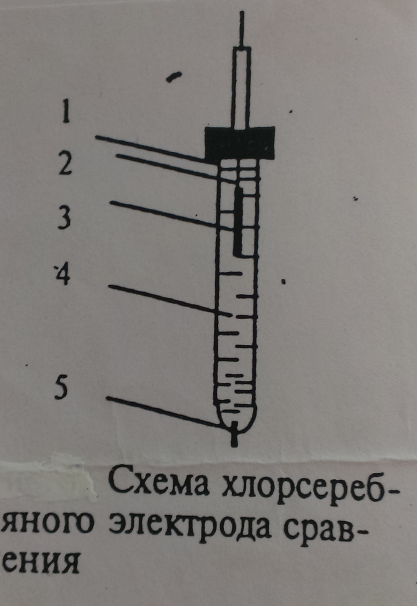 В потенциометрии наиболее часто применяются хлорсеребряный и каломельный электроды сравнения (рис. 6,7).
В потенциометрии наиболее часто применяются хлорсеребряный и каломельный электроды сравнения (рис. 6,7).
Хлорсеребряный электрод представляет систему, состоящую из стекольного сосуда (1), внутри которого помещена серебряная проволока (2), покрытая хлоридом серебра AgCl (3) и опущенная в раствор хлорида калия (4) с исследуемым раствором. Такой электрод контактирует через асбестовую ткань (5).
Электродная реакция хлорсеребряного электрода описывается уравнением
| Рисунок 6 |
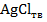 ,
, 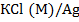 (где M – молярная концентрация HCl). Потенциал хлорсеребряного электрода по отношению к стандартному водородному электроду + 0,1988 В при 25° С.
(где M – молярная концентрация HCl). Потенциал хлорсеребряного электрода по отношению к стандартному водородному электроду + 0,1988 В при 25° С.
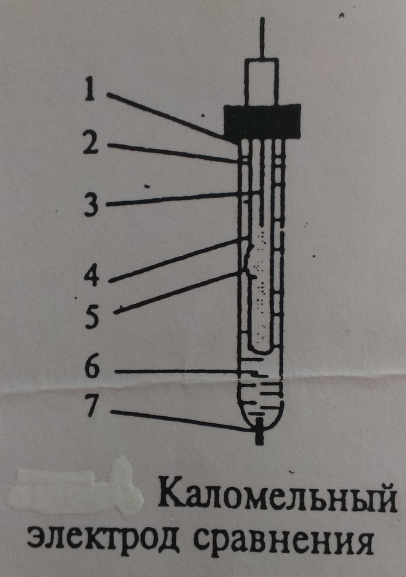 Каломельный электрод представляет собой систему, состоящую из стеклянного сосуда (1), в который помещен стеклянный сосуд меньших размеров (2), заполненный пастой (4) из Hg,
Каломельный электрод представляет собой систему, состоящую из стеклянного сосуда (1), в который помещен стеклянный сосуд меньших размеров (2), заполненный пастой (4) из Hg, 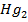 ,
, 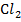 и КСl, в которую опущена амальгамированная платиновая проволока (3). Во внутреннем стеклянном сосуде имеется отверстие (5), через которое паста контактирует с насыщенным раствором КСl (6), залитым в сосуд (1). Для контакта с исследуемым раствором в сосуде (1) вставлена асбестовая ткань (7).
и КСl, в которую опущена амальгамированная платиновая проволока (3). Во внутреннем стеклянном сосуде имеется отверстие (5), через которое паста контактирует с насыщенным раствором КСl (6), залитым в сосуд (1). Для контакта с исследуемым раствором в сосуде (1) вставлена асбестовая ткань (7).
Схематически каломельный электрод можно представить в виде:
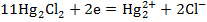
| Рисунок 7 |
В заключение необходимо отметить, что различают электроды первого и второго рода.
Примером электродов первого рода, обратимых относительно катиона, может служить любой металл в растворе его соли.
Электродом второго рода называется металлический электрод, погруженный в раствор трудно растворимого соединения этого металла (соль, оксид) и хорошо растворимого электролита с одноименным анионом. Примером могут служить каломельный и хлорсеребряный электроды сравнения.
Потенциометрические измерения
Для проведения потенциометрических измерений необходимо иметь гальванический элемент, в простейшем случае состоящий из индикаторного электрода и электрода сравнения. Измерение ЭДС производится специальными приборами (рис.8).
Пример:
Рисунок 8
Для анализа разбавленного водного раствора нитрата серебра нужно собрать гальванический элемент, в котором индикаторным электродом является серебряная проволока, стащенная в раствор Ag  (1), а электродом сравнения - насыщенный каломельный полиэлемент (2). Для предотвращения осаждения хлорида серебра электрод сравнения соединен с исследуемым раствором с помощью электролитического ключа (3) заполненного, например, 3%-ным агар-агаром в 1М K
(1), а электродом сравнения - насыщенный каломельный полиэлемент (2). Для предотвращения осаждения хлорида серебра электрод сравнения соединен с исследуемым раствором с помощью электролитического ключа (3) заполненного, например, 3%-ным агар-агаром в 1М K  .
.
Можно составить гальванический элемент, используя каломельный электрод сравнения. В нем роль электролитического ключа будет играть раствор КСl в каломельном электроде, который контактирует с анализируемым раствором через асбестовую ткань.
В потенциометрическом анализе существует прямая потенциометрия и потенциометрическое титрование.
Прямая потенциометрия
Потенциал индикаторного электрода в анализируемом растворе сравнивается с потенциалом этого же электрода, погруженного в стандартный раствор того же вещества.
ГРАФИК
Для практических измерений этим методом строят калибровочный график. Для этого измеряют потенциал индикаторного электрода в стандартах раствора с определённой концентрацией (активностью) ионов. Откладывая полученное значение ф по оси ординат (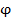 1) определяют концентрацию (с1) вещества в растворе.
1) определяют концентрацию (с1) вещества в растворе.
Метод прямой потенциометрии сочетает в себе такие достоинства: простота, экспрессносгь, возможность работы с малыми объектами растворов.
Основная трудность метода - выбор индикаторного электрода. Он должен быть устойчивым к действию раствора, реакция должна бьггь обратимой.
Использование, ионоселективных электродов значительно расширило возможности метода. В настоящее время, помимо определения ионов H+, прямой потенциометрией определяют ионы Са, Mg, Na, Ag, Au, Hg и др.
Потенциометрическое титрование.
Аналитическим сигналом в этом методе служит изменение потенциала индикаторного электрода в процессе титрования.
Результаты представляют в виде кривой титрования в координатах «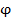 , В -
, В - 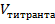 », или «pH -
», или «pH - 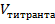 ». Обычно вместо
». Обычно вместо 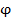 , В используют Е, В, где Е - ЭДС гальванического элемента, величина которой определяется потенциалом индикаторного электрода. Тогда получают зависимость:
, В используют Е, В, где Е - ЭДС гальванического элемента, величина которой определяется потенциалом индикаторного электрода. Тогда получают зависимость:
«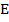 , В -
, В - 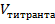 »
»
По кривой потенциометрического титрования определяется эквивалентная точка, по которой рассчитывается концентрация определяемого вещества.
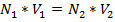
где: 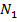 - определяемая концентрация вещества в растворе.
- определяемая концентрация вещества в растворе.
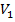 - объем пробы исследуемого вещества, мл.;
- объем пробы исследуемого вещества, мл.;
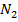 - концентрация титранта: 2-эквив.
- концентрация титранта: 2-эквив.
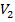 - эквивалентный объем титранта, мл.
- эквивалентный объем титранта, мл.
При определении концентрации вещества в растворе методом ПТ необходимо иметь в виду следующее:
- чувствительность метода определяется правильным выбором индикаторного электрода; величина скачка потенциала вблизи эквивалентной точки тем больше чем выше концентрация исследуемого раствора;
- величина скачка потенциала зависит также от константы ионизации слабой к -ты или слабого основания и тем больше, чем больше константа;
- в случае титрования смесей двух или более веществ сначала оттитровывается вещество, имеющее более высокую степень ионизации, окислительно - восстановительный потенциал или устойчивость образующегося комплексного соединения;
- в начале титрования титр ант можно приливать большими порциями, а вблизи эквивалентной точки.
Анализируемому раствору добавляется такой титрант, который образует с ионами малорастворимое, выпадающее в осадок соединение. Нужно подобрать такой индикаторный электрод, который обменивается с электролитом осаждаемыми ионами. В процессе титрования концентрация потенциалоопределяющих ионов будет уменьшаться (т.к. Они будут переходить в осадок), что в соответствии с уравнением Нернста приведет к изменению потенциала индикаторного электрода.
Пример:
Определим концентрацию ионов серебра в водном растворе  (рис. 9). Индикаторным электродом служит серебряная проволока (2), а электродом сравнения каломельный полуэлемент (3). В качестве титранта возьмем раствор
(рис. 9). Индикаторным электродом служит серебряная проволока (2), а электродом сравнения каломельный полуэлемент (3). В качестве титранта возьмем раствор 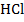 (1).
(1).
| Рисунок 9 |
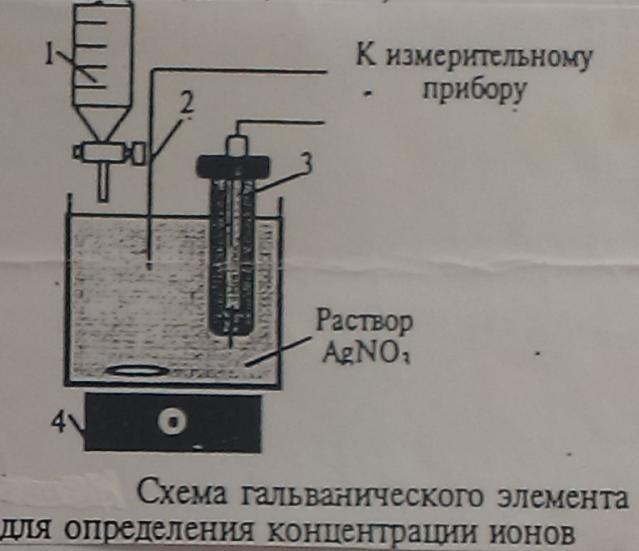 При добавлении титранта к раствору
При добавлении титранта к раствору  при перемешивании магнитной мешалкой (4) ионы
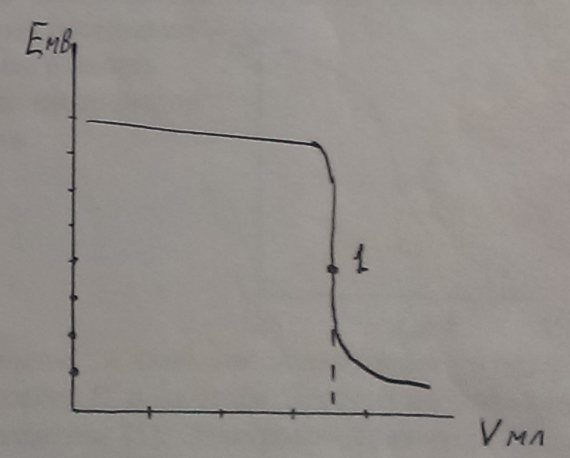
при перемешивании магнитной мешалкой (4) ионы  + будут переходить в осадок (
+ будут переходить в осадок (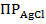 =
= 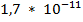 )
)
Ag+ + 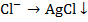
ЭДС элемента будет
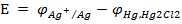
ЭДС определяется только значениями потенц. 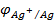 , которые зависят от изменения концентрации (точнее, активности) ионов Ag+ в растворе, т. к. значение
, которые зависят от изменения концентрации (точнее, активности) ионов Ag+ в растворе, т. к. значение 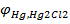 – const.
– const.
Снижение концентрации ионов Ag+ ведет к снижению ЭДС. Строят график зависимости изменения ЭДС от объема добавленного титранта.
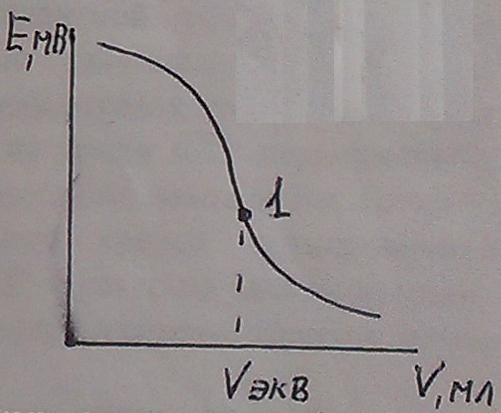
 Получаем характерную кривую потенциометрического титрования. В точке эквивалентности происходит резкий скачек ЭДС определяемый изменение потенциала индикаторного электрода.
Получаем характерную кривую потенциометрического титрования. В точке эквивалентности происходит резкий скачек ЭДС определяемый изменение потенциала индикаторного электрода.
Конечную точку титрования (тучку эквивалентности определяют как среднюю точку участка, соответствующий вертикальному ходу кривой). Точность тем выше, чем больше величина скачка (чем выше концентрация).
По данному способу возможно титрование смеси ионов, если ПР образующихся осадков отличаются друг от друга не менее чем на 3 порядка.
| Рисунок 10 – График зависимости изменения ЭДС от объема добавленного титранта |
При добавлении титранта к анализируемому раствору количество ионов, концентрацию которых нужно определить, уменьшается, т.к. они образуют малодиссоциируемый комплекс. В связи с этим будет изменяться потенциал индикаторного электрода и, следовательно ЭДС гальванического элемента.
Пример:
Титрование ционид - ионов раствором нитрата серебра. Индикативным электродом служит серебряная проволока. Электродом сравнения каломельный полуэлемент.
Ионы серебра с ионами цианида образуют комплекс (реакция обратима)
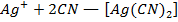
В процессе титрования потенциал сер. электрода будет возрастать, будет возрастать и ЭДС гальванического элемента (рис. 11) и в точке эквивалентности (1) обнаружится резкий скачек потенциала. Вслед за скачком идет почти горизонтальная кривая, соответствующая окончанию процесса комплексообразования. При дальнейшем добавлении  , будет образовываться малодиссоциированный осадок
, будет образовываться малодиссоциированный осадок 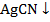 . Скачек потенциала тем больше, чем меньше константа диссоциации комплекса и выше концентрация раствора. При использовании органических комплексаообразующих титрантов скачек сильно зависит от pH раствора, т. к. при различных pH образуются комплексы с различной const нестойкости и различного состава.
. Скачек потенциала тем больше, чем меньше константа диссоциации комплекса и выше концентрация раствора. При использовании органических комплексаообразующих титрантов скачек сильно зависит от pH раствора, т. к. при различных pH образуются комплексы с различной const нестойкости и различного состава.
Окислительно - восстановительное титрование.
При протекании окислительно - восстановительной реакции, в растворе имеются ионы в окислительной и восстановительной формах. Если подобрать индикаторный электрод, обратимый относительно этих ионов, то по мере течения реакции концентрация ионов, находящихся в окислительной и восстановительной формах будет изменяться. В соответствии с формулой Нернста, будет меняться величина электродного потенциала и, следовательно, ЭДС гальванического элемента.
Пример:
Титрование хлорида железа (III) раствором хлорида олова (II).
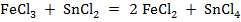
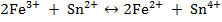
 составил гальванический элемент (рис. 9), в котором индикаторным электродом служит Pt (2), а электродом сравнения является каломельный полуэлемент (3)и заполним его хлоридом железа (III). Титрантом является раствор хлорида олова (II). Изменение концентрации ионов Fe3+ и Fe2+ в процессе титрования повлечет за собой изменения величины
составил гальванический элемент (рис. 9), в котором индикаторным электродом служит Pt (2), а электродом сравнения является каломельный полуэлемент (3)и заполним его хлоридом железа (III). Титрантом является раствор хлорида олова (II). Изменение концентрации ионов Fe3+ и Fe2+ в процессе титрования повлечет за собой изменения величины 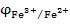 и, следовательно, ЭДС гальванического элемента. ЭДС вначале изменяется незначительно, а затем наблюдается резкий скачек. Получается характерная кривая потенциометрического титрования. Скачек потенциала в точке эквивалентности тем больше, чем больше разность стандартных окислительно - восстановительных потенциалов и концентрация титруемого вещества и титранта.
и, следовательно, ЭДС гальванического элемента. ЭДС вначале изменяется незначительно, а затем наблюдается резкий скачек. Получается характерная кривая потенциометрического титрования. Скачек потенциала в точке эквивалентности тем больше, чем больше разность стандартных окислительно - восстановительных потенциалов и концентрация титруемого вещества и титранта.
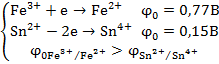
Кислотно - основное титрование
| Рисунок 11 |
 в растворе. Поэтому индикаторным электродом чаще всего служит стеклянный электрод (1). Электродом сравнения обычно служит каломельный полуэлемент (2) (или хлорсеребряный).
в растворе. Поэтому индикаторным электродом чаще всего служит стеклянный электрод (1). Электродом сравнения обычно служит каломельный полуэлемент (2) (или хлорсеребряный).
Потенциал стеклянного электрода обусловлен объемом ионов щелочных металлов, находящихся в стекле, с ионами водорода (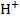 ) из раствора, поэтому изменение концентрации последних в растворе при титровании повлечет за собой изменение электродного потенциала и ЭДС элемента.
) из раствора, поэтому изменение концентрации последних в растворе при титровании повлечет за собой изменение электродного потенциала и ЭДС элемента.
При титровании раствора сильной кислоты раствором сильной щелочи (или наоборот) происходит уменьшение концентрации 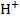 , что ведет к уменьшению потенциала и соотв. ЭДС
, что ведет к уменьшению потенциала и соотв. ЭДС
НСl + NaOH = NaCl + Н2O или 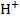 + O
+ O 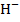 = Н2O
= Н2O
| Рисунок 12 |
 Это ведет к тому, что происходит резкий скачек и получается типичная кривая потенциалометрического титрования. Сложнее обстоит дело при титровании слабых кислот и оснований, особенно в случае, когда титрант тоже является слабым основанием или слабой кислотой, т. к. слабые кислоты и щелочи диссоциируют не полностью, то концентрация
Это ведет к тому, что происходит резкий скачек и получается типичная кривая потенциалометрического титрования. Сложнее обстоит дело при титровании слабых кислот и оснований, особенно в случае, когда титрант тоже является слабым основанием или слабой кислотой, т. к. слабые кислоты и щелочи диссоциируют не полностью, то концентрация 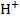 в растворе заметно меньше, чем при сильных кислотах или основаниях. Кроме того, в процессе титрования слабых кислот или оснований в растворе будет получаться буферная смесь, например слабой кислоты и её соли. В результате получится кривая со слабым скачком.
в растворе заметно меньше, чем при сильных кислотах или основаниях. Кроме того, в процессе титрования слабых кислот или оснований в растворе будет получаться буферная смесь, например слабой кислоты и её соли. В результате получится кривая со слабым скачком.
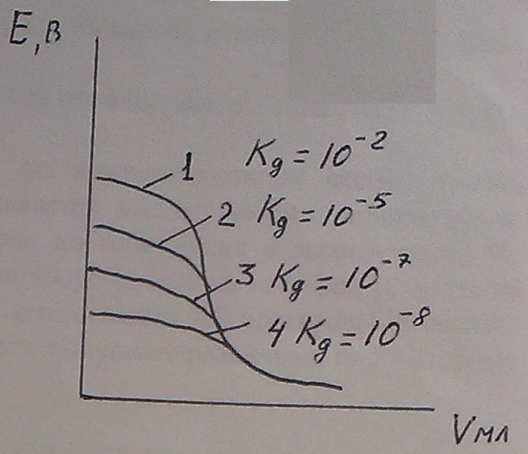
В связи с этим очень слабые кислоты и очень разбавленные растворы титровать вообще нельзя, т. к. на кривой титрования не будет скачка потенциала и не будет обнаружена эквивалентная точка (если Кд = 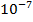 , то не титруется).
, то не титруется).
Можно титровать смесь к - т, если их к - ты диссоциации отличаются не менее чем на 4 порядка.
Способы нахождения конечной точки титрования
Основной задачей при потенциометрическом титровании является обнаружение скачка потенциала отвечающего конечной точки титрования и нахождение эквивалентной точки.
Для этого применяют два способа расчетный и графический.
Расчетный способ. Кривые титрования можно построить на основании расчетных величин потенциала в зависимости от концентрации раствора, а потенциал в точке эквивалентности рассчитать на основании этапа реакции. Однако этот способ в практических работах не используется.
Графический способ. Строится кривая потенциометрического титрования в координатах «ЭДС главного элемента (или потенциал индикаторного электрода) — объем прибавленного титранта». На рис. 23 (а), приведена интегральная кривая потенциометрического титрования. Для нахождения эквивалентной точки проводят две параллельные касательные к пологим ветвям кривой; третью касательную к восходящей (или исходящей) до пересечения с двумя первыми. Полученный отрезок прямой (mn) делят пополам и получают эквивалентную точку «А». Опуская из точки «А» перпендикуляр, получают эквивалентный объем титранта. Более точным методом нахождения конечной точки титрования является построение дифференциальной кривой потенциального титрования в координатах  Е/
Е/  V - V мл. (Рис. «б»), где
V - V мл. (Рис. «б»), где  Е - разность между вторым и первым значениями ЭДС и т. д. В этом случае максимум на кривой соответствует конечной точки титрования.
Е - разность между вторым и первым значениями ЭДС и т. д. В этом случае максимум на кривой соответствует конечной точки титрования.
В некоторых случаях. Когда конечную точку нужно зафиксировать наиболее точно, её находят по кривой зависимости  2Е/
2Е/  2 V - V, мл. (рис.).
2 V - V, мл. (рис.).
Аппаратура
В потенциометрии различают два вида измерительных приборов - потенциометры, работающие по компенсационной схеме; - высокоомные вольтметры. Компенсационный метод определения ЭДС (рис. 24) заключается в том, что параллельно электролитической ячейки (7), состоящей их 2-х электродов (индикаторного и эл. сравнения) подключается нормальный элемент Вестона (6), ЭДС которого постоянна и равна 1,0186 В при 25° С и источник постоянного тока (2) с переменным сопротивлением (3) (для регистрации регулирования напряжения) и реохорд (4). Замкнув цепь и передвигая реохорд добиваются компенсации ЭДС нормального элемента, т.е. ЭДС аккумулятора и НЭ =, затем отключают НЭ и подключают ячейку. Опять передвигая реохорд, добиваются компенсации ЭДС, затем определяют ЭДС гальванического элемента.
Наша промышленность выпускает высокоомные потенциометры типа ППТВ – 1, Р – 300, Р – 307 и др.
(Рис. 25 ) Устройства, измеряющие ЭДС по компенсационной схеме (набор сопротивлений, Н. Э. Вестона, аккумулятор) называется высокоомными вольтметрами. Приборы этого типа дают менее высокую точность, но они проще в эксплуатации. Из электродов сравнения наиболее широко применяется хлорсеребряный электрод (т. к. он не имеет в своем составе ртути). В настоящее время выпускаются ХС электроды сравнения ЭВЛ — 1МЗ, ЭВЛ — 1М1 и др. Наша промышленность выпускает различные индикаторные электроды:
- металлические: платиновые ЭТПЛ - 1 и ЭПЛ - 1;
- стеклянные для определения pH: ЭСП — 11Г -05; ЭСЛ - 41Г-04 и др.;
- пленочные пластифицированные электроды ЭМ – 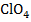 – 01; ЭМ –
– 01; ЭМ – 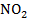 – 01
– 01
следует заметить, что метод потенциометрии незаменим в тех случаях, когда измерения необходимо проводить в условиях отсутствия электрического тока: в походах, экспедициях.
Date: 2015-07-01; view: 1873; Нарушение авторских прав