
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Глюкоза в эритроцитах
|
|
В эритроцитах в процессе гликолиза происходит активное потребление глюкозы. Эритроциты занимают 40-45 % объема крови. При созревании в костном мозге они теряют ядро и все субклеточные органеллы. Без ядра у них отсутствует способность синтезировать нуклеиновые кислоты, без рибосом - белок, без митохондрий - окислять липиды. Поэтому эритроциты способны утилизировать фактически только глюкозу. Метаболизм глюкозы в эритроцитах исключительно анаэробный, хотя они обогащены кислородом. В эритроцитах большая часть глюкозы окисляется до лактата, который освобождается в кровоток. При этом образуется АТФ, энергия которого используется в основном для поддержания электрохимического и ионных градиентов через плазматическую мембрану. Около 10 % потока глюкозы в эритроцитах утилизируется в пентозофосфатном шунте, что используется для защиты клеток от повреждения свободнорадикальными соединениями (Fe+2, радикалы кислорода). Около 10 - 20 % глюкозы используется для образования 2,3-дифосфоглицерата (2,3ДФГ) - аллостерического регулятора сродства кислорода с Hb. Синтез 2,3ДФГ - специфическая функция эритроцитов; гликолиз и пентозозофосфатный шунт присущи всем клеткам организма млекопитающих.
Человек массой 70 кг имеет около 5 л крови и свыше 2 кг эритроцитов. Эти клетки потребляют в день около 20 г (0,1 моль) глюкозы, что составляет около 10 % общего метаболизма глюкозы организма. Эритроциты имеют самую высокую относительную скорость утилизации глюкозы в организме, примерно 10 г глюкозы/кг ткани в день, тогда как в целом организм потребляет глюкозу со скоростью 2,5 г/кг в сутки. Поэтому кровь для определения глюкозы не должна храниться вместе с эритроцитами или же необходимо использовать ингибиторы гликолиза. Даже при комнатной температуре в эритроцитах активно утилизируется глюкоза. Результатом гликолиза будет снижение в пробе глюкозы и накопление лактата и как результат - закисление среды (снижение рН). Как можно этому противостоять? Сульфгидрильные реагенты являются ингибиторами фермента глицеральдегид-3-фосфатдегидрогеназы (Гл-3-ФДГ). Однако проще использовать NaF, который добавляется в пробирку для взятия пробы (сухой или в растворе - 1 мг на 1 мл крови). Фторид является конкурентным ингибитором фермента енолазы, поэтому его также испльзуют для подавления утилизации глюкозы клетками крови при ее транспортировке и хранении. Для более надежного ингибирования утилизации глюкозы эритроцитами вместе с фторидом нужно добавлять фосфат и Mg+2. При этом в активном центре фермента образуется комплекс, который не вытесняется избытком субстрата (2 фосфоглицератом) и ингибирование гликолиза будет полным. При взятии крови с фторидом проба для определения глюкозы может храниться в течение суток.
САХАРНЫЙ ДИАБЕТ.
По определению Международного Экспертного Комитета по диагностике и классификации сахарного диабета (1997), сахарный диабет – это группа метаболических (обменных) заболеваний, характеризующихся гипергликемией, которая является результатом дефектов секреции инсулина, действия инсулина или обоих этих факторов. Хроническая гипергликемия при диабете сочетается с повреждением, дисфункцией и недостаточностью различных органов, особенно глаз, почек, нервов, сердца и кровеносных сосудов.
В развитие диабета вовлечены несколько патогенетических процессов: от аутоиммунного повреждения b-клеток поджелудочной железы с последующим дефицитом инсулина до нарушений, провоцирующих резистентность к действию инсулина. Инсулинорезистентность – результат неадекватной секреции инсулина и/или сниженного тканевого ответа на инсулин в одной или нескольких точках на сложных путях действия гормона. Нарушение секреции инсулина и дефекты его действия часто сосуществуют у одного и того же больного, и порой неясно, какое нарушение является первичной причиной гипергликемии.
Симптомы выраженной гипергликемии включают полиурию, полидипсию, снижение веса, иногда с полифагией, и снижение остроты зрения. Ухудшение роста и восприимчивость к инфекциям также могут сопровождать хроническую гипергликемию. Острые, угрожающие жизни осложнения диабета – гипергликемия с кетоацидозом, гиперосмолярный синдром без кетоза, лактоацидоз, а также гипогликемическая кома.
Хронические осложнения диабета включают ретинопатию с возможным развитием слепоты; нефропатию, ведущую к почечной недостаточности; периферическую нейропатию с риском образования язв на нижних конечностях и ампутации, а также сустава Шарко; автономную нейропатию, вызывающую гастроинтестинальные, урогенитальные, сердечно-сосудистые симптомы и половую дисфункцию. Среди больных диабетом высока частота атеросклеротических поражений сосудов сердца, периферических и церебральных сосудов. Часто у больных обнаруживается гипертония, нарушения метаболизма липопротеидов и парадонтоз. Эмоциональное и социальное влияние диабета и потребности лечения могут вызвать существенную психосоциальную дисфункцию у больных и членов их семей.
Подавляющее большинство случаев диабета относится к двум обширным этиопатогенетическим категориям (более детально обсуждающимся ниже). Причина диабета I типа (I категории) – абсолютный дефицит секреции инсулина. Лица с высоким риском развития этого типа диабета часто могут быть идентифицированы по серологическим признакам аутоиммунного патологического процесса в панкреатических островках, а также по генетическим маркерам. При диабете II типа (II категории, более распространенной) причина заключается в комбинации резистентности к инсулину и неадекватного компенсаторного инсулин-секреторного ответа. В этой категории степень гипергликемии достаточна, чтобы привести к патологическим и функциональным изменениям в органах-мишенях, но эта гипергликемия может не вызывать клинических симптомов и может существовать в течение длительного периода времени до момента выявления диабета. В течение этого бессимптомного периода можно обнаружить нарушение углеводного обмена путем определения уровня глюкозы плазмы натощак или после пероральной нагрузки глюкозой.
Таблица 6
| Классификация сахарного диабета (ВОЗ, 1999) | |
| Тип СД | Характеристика заболевания |
| Сахарный диабет 1 типа · Аутоиммунный · Идиопатический | Деструкция b-клеток поджелудочной железы, обычно приводящая к абсолютной инсулиновой недостаточности. |
| Сахарный диабет 2 типа | С преимущественной инсулинорезистентностью и относительной инсулиновой недостаточностью или преимущественным дефектом секреции инсулина с инсулинорезистентностью или без нее. |
| Гестационный сахарный диабет | Возникает в период беременности |
| Другие типы сахарного диабета | · Генетические дефекты функции b-клеток · Генетические дефекты в действии инсулина · Болезни экзокринной части поджелудочной железы · Эндокринопатии · Диабет, индуцированный лекарствами или химикатами · Диабет, индуцированный инфекциями · Необычные формы иммуно-опосредованного диабета · Другие генетические синдромы, сочетающиеся с сахарным диабетом. |
Диабет I типа (деструкция b-клеток, обычно ведущая к абсолютному дефициту инсулина)
Иммуноопосредованный диабет.
Эта форма диабета, прежде обозначавшаяся терминами инсулинзависимый диабет (ИЗСД), диабет 1 типа является результатом клеточно-опосредованной аутоиммунной деструкции b-клеток поджелудочной железы. Чаще диабет 1 типа встречается у детей и подростков, с чем и было связано ранее употреблявшийся термин «юношеский диабет», однако заболеть могут люди любого возраста. Отдельную группу диабета 1 типа представляют больные, у которых диабет развился в более позднем возрасте (35-75 лет) и который характеризуется наличием аутоантител к различным антигенам островка поджелудочной железы. Учитывая особенности клинического течения этого типа диабета и наличие в сыворотке крови таких больных цитоплазматических и других антител, L. C. Groop и соавторы еще в 1986г. назвали его латентным диабетом 1 типа. Значительно позже в 1993 T. Tuomi и соавторы показали, что латентный аутоиммунный диабет взрослых (LADA), который часто симулирует сахарный диабет 2 типа, характерно медленное ухудшение метаболического профиля и постепенный переход в инсулинозависимость. Кроме того, для него характерно наличие в сыворотке крови, помимо цитоплазматических антител, аутоантител к глютаматдекарбоксилазе. На основании приведенных данных этот тип диабета был отнесен к 1 типу сахарного диабета.
Эндокринная функция поджелудочной железы связана в основном с островками Лангерганса, которые занимают 2-3 % от массы поджелудочной железы (рис. 11).
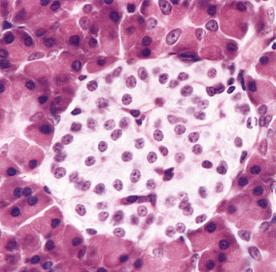
| Рис. 11. Островок Лангерганса. Каждый островок состоит примерно из 2000 эндокринных клеток: b-клетки (примерно 75 %) вырабатывают инсулин, a-клетки (около 20 %) синтезируют глюкагон, в дельта-клетках образуются соматостатин и гастрин, рр—клетки секретируют панкреатический полипептид, в состав островков входят также неэндокринные клетки - макрофаги, фибробласты, эндотелиальные и другие клетки. Окружен островок ацинарными структурами, продуцирующими пищеварительные ферменты. |
В 1980-90 гг получены убедительные данные, что в крови здоровых людей присутствуют сотни разных по антигенной направленности естественных физиологических аутоантител: к гормонам, рецепторам, комплексам межклеточного матрикса, белкам цитоскелета, ДНК, гистонам, многим ферментам и другим эндогенным соединениям. Аутоантитела синтезируются в основном CD5+-лимфоцитами, составляющими 20-30 % общей В-клеточной популяции. В организме человека на протяжении всей жизни производится сотни миллиграммов аутоантител разной специфичности, синтез которых не является потенциально опасным. Естественные антитела, вероятно, выполняют важные регуляторные функции – специфически и обратимо меняют функциональную активность своих мишеней, предупреждают лабильные молекулы гормонов от преждевременной протеолитической деградации, обеспечивают адресную доставку соответствующих молекул к участкам специфического связывания, в которых происходит диссоциация комплексов антиген-антитело и взаимодействие пептидных лигандов со специализированными высокоаффинными рецепторами. Потективная роль антител в подобных случаях проявляется не только в экранировании пептидов от атаки протеолитических ферментов, но и предотвращает их неэффективное диффузное размазывание по множеству участков низкоаффинного неспецифического связывания. В результате биологическая эффективность действия гормонов резко возрастает.
Состояние физиологической нормы определяется поддержанием «золотой середины» концентрации любых регуляторных молекул, в том числе естественных аутоантител. Если же продукция и концентрация аутоантител выходит за физиологически допустимые пределы, то развиваются патологические изменения, в том числе деструктивные аутоиммунные процессы. Из-за высокой специфичности антител их гиперпродукция определяет характерные клинические особенности.
Специфические антиинсулиновые антитела выполняют по отношению к инсулину транспортно-протективную функцию, являются нормальным компонентом сыворотки здорового человека. Их физиологическая концентрация близка к значениям 1 – 5 мкг/мл. У больных СД I типа сывороточное содержание аутоантител к инсулину класса IgG повышено примерно у половины пациентов, в 10 – 15 % случаев гиперпродукция антител достигает 200 % и более. Динамические наблюдения показывают, что периодическое аномальное повышение содержания таких антител является характерной особенностью большинства, если не всех больных СД I типа.
Достаточно уверенно можно констатировать, что деструкция b-клеток поджелудочной железы является клеточно-опосредуемым иммунопатологическим процессом. Антипанкреатические антитела (к инсулину, островковой глутаматдегидрогеназе, некоторым мембранным белкам и другим антигенам) обычно регистрируются за годы до клинической манифестации болезни. По-видимому, на ранних стадиях развития заболевания именно антитела к антигенам островков Лангерганса выступают в качестве триггеров аутодеструктивных процессов, выдавая команду на уничтожение собственных островковых клеток антигеннеспецифичным макрофагам и NK-клеткам. Этот процесс может продолжаться годами, длительно оставаясь компенсированным. Антигенспецифичные цитотоксические Т-клетки вовлекаются в процессы аутодеструкции на более поздних стадиях, в результате вялотекущий процесс завершается быстрым разгромом b-клеток, что переводит заболевание в стадию клинической манифестации, это происходит когда уже 80-85% массы b-клеток погибла.
Маркеры иммунной деструкции b-клеток включают аутоантитела к островковым клеткам (ICAs), аутоантитела к инсулину (IAAs), аутоантитела к декарбоксилазе глютаминовой кислоты (GAD65) и аутоантитела к тирозин-фосфатазам IA-2 и IA2b. Один вид, а обычно более, этих аутоантител присутствует у 85-90% больных СД 1 типа при первоначальном обнаружении гипергликемии натощак.
ICAs – это антитела к антигенам, локализованным в цитоплазме клеток островков Лангерганса. Они определяются в сыворотке 0,2 – 3,5 % здоровых людей, у 2 – 6 % лиц без диабета, но являющихся кровными родственниками больных СД 1 типа, и у 70 – 80 % больных с диагностированным СД 1 типа. Чем моложе пациент, у которого обнаружены ICAs и чем выше их титр, тем большая вероятность развития СД 1 типа.
IAAs - аутоантитела к собственному инсулину определяются в сыворотке больных СД 1 типа еще до того, как им назначают терапию инсулином. IAAs имеют четкую корреляцию с возрастом. Если СД 1 типа возник у ребенка до 5 лет, в 100 % случаев у него будут IAAs. Если же СД 1 типа возникает у взрослого, то IAAs выявляются примерно у 20 % больных. Исследование в семьях показало, что у 37 % лиц, имеющих IAAs и ICAs антитела, СД 1 типа разовьется в течение 1,7 года.
GAD65 – аутоантитела к глютаматдекарбоксилазеопределяются у 70 – 80 % больных СД 1 типа. Мишенью для этих антител является белок с молекулярной массой 65 кД. GAD могут выявляться за несколько месяцев и даже лет до манифестации СД 1 типа.
Заболевание имеет также четкую ассоциацию с HLA, связанную с генами DQA и В, а также на него влияют гены DRB. Эти аллели HLA-DR/DQ могут быть как предрасполагающими, так и протективными. Показано, что после вирусной инфекции резко возрастает частота проявления сахарного диабета I типа, это, в частности, характерно для вируса коксаки В4, цитомегаловируса, врожденной краснухи и некоторых других вирусов, которые относятся к этиологическим факторам I типа СД. Воспаление островков поджелудочной железы (инсулиты) приводят к повреждению b-клеток и снижению синтеза в них инсулина. Доказано, что Т-клеточная реакция, направленная против вирусных антигенов, может затрагивать клеточные антигены островков и тем самым вызывать повреждения клеток. Ведущую роль в развитии каскада иммунологических реакций, приводящих в деструкции b-клеток, отводят макрофагальным элементам, в том числе, входящим в структуру островков Лангерганса. Под влиянием вирусов, химических агентов на поверхности b-клеток экспрессируется антиген. Макрофаги опознают этот антиген как чужеродный, вместе с Т-хелперами они выбрасывают интерлейкины и лимфокины (ИЛ-1, g-интерферон, ФНО), которые активируют иммунокомпетентные клетки. В результате всего в поджелудочной железе развивается аутоиммунное воспаление. Последовательность патогенетических факторов сахарного диабета 1 типа представлена в виде схемы на рис. 12.
 |
Рис. 12. Патогенетические факторы сахарного диабета 1 типа.
|
Выявление доклинической стадии сахарного диабета 1 типа является важной задачей, поскольку влияет на дальнейшее течение заболевания. При снижении секреторной активности β-клеток на их поверхности появляется меньше антигенов, распознаваемых иммунной системой как аллоантигены. Для снижения секреторной активности β-клеток лицам в доклинический период назначают малые дозы продленного инсулина, что делает течение диабета в будущем более управляемым и является профилактикой кетоацидоза при манифестации заболевания
Диагностика доклинического периода манифестации заболевания достигается с помощью определения аутоантител (ICA, GAD-65, GAD-67) или по оценке инсулинового ответа на внутривенную нагрузку глюкозой. Уже на стадии доклинических проявлений деструкции исчезает первая фаза инсулинового ответа на глюкозную нагрузку. Разработана так называемая модель двойных параметров (увеличение JCA + снижение I фазы секреции инсулина + антитела к инсулину). Если эти положительные признаки сочетаются с наследственной предрасположенностью (HLA типирование), то можно с большой вероятностью поставить диагноз деструкции инсулярного аппарата на доклинических этапах СД I типа. Возможны различные варианты клинической манифестации СД I типа. У некоторых, особенно у детей и подростков, в манифестации заболевания может быть представлен кетоацидоз. Другие имеют умеренную гипергликемию натощак, которая может быстро смениться выраженной гипергликемией и/или кетоацидозом при присоединении инфекций или стрессов. В то же время иные, особенно взрослые, могут сохранять остаточную функцию b-клеток на уровне, достаточном для предотвращения кетоацидоза в течение многих лет. Многие больные с такой формой диабета I типа в конечном счете становятся жизненно зависимыми от инсулина и находятся в состоянии риска по кетоацидозу. На этой последней стадии заболевания секреция инсулина мала или отсутствует, что проявляется низким или неопределяемым уровнем С-пептида плазмы. Эти больные также часто склонны к другим аутоиммунным заболеваниям, таким как болезнь Грейвса, тиреоидит Хашимото, болезнь Аддисона, витилиго и пернициозная анемия.
Идиопатический диабет.
Для некоторых форм диабета I типа этиологические факторы не известны. У ряда таких больных постоянно регистрируется инсулинопения и наклонность к кетоацидозу, но у них отсутствуют показатели аутоиммунного процесса. Такое течение сахарного диабета I типа характерно для некоторых популяций людей африканского или азиатского происхождения. У пациентов с этой формой диабета эпизодически бывает кетоацидоз, между периодами обострения выявляется разная степень инсулинодефицита. Эта форма диабета имеет четкое наследование, но не ассоциирована с HLA. Абсолютная потребность в заместительной инсулинотерапии у этих больных может появляться и исчезать.
Диабет II типа (от преобладающей инсулинрезистентности с относительным инсулинодефицитом до преобладающего дефекта секреции инсулина с инсулинрезистентностью)
Эта форма диабета, которую прежде обозначали как инсулиннезависимый сахарный диабет (ИНСД), диабет II типа, диабет со «взрослым» началом, протекает с резистентностью к инсулину и обычно относительной (чаще, чем абсолютной) недостаточностью инсулина. Изначально, а часто на всем протяжении жизни, в лечении этих больных инсулин не является жизненно необходимым. Существует, по-видимому, много различных причин этой формы диабета, по прогнозам доля больных этой категории в будущем будет увеличиваться.
Кетоацидоз редко спонтанно развивается при этом типе диабета, а когда наблюдается, обычно связан со стрессом в результате другого заболевания, например, инфекции. Эта форма диабета часто остается недиагностированной многие годы, так как гипергликемия развивается постепенно, ранние стадии подчас недостаточно выражены, чтобы больной мог отметить какие-либо из классических симптомов диабета. Тем не менее, такие больные находятся в состоянии повышенного риска макро- и микрососудистых осложнений.
В развитии заболевания роль наследсвенности не вызывает сомнения, так как в многочисленных исследованиях было показано, что вероятности возникновения заболевания у однояйцевых близнецов достигает 100%. Однако генетические факторы четко не определены. Несколько генов, которые могли бы иметь ключевое значение в развитии диабета, были идентифицированы, в том числе гены, ответственные за функцию гексокиназы и трансмембранный перенос глюкозы. Выявлено несколько генных ассоциаций, наличие которых увеличивает склонность к развитию СД II типа. Ожирение, развивающиеся в результате снижения физической активности и избыточного питания, усугубляет генетически заложенную инсулинорезистентность и способствует реализации генетических дефектов, которые приводят к развитию сахарного диабета. Хотя большинство больных сахарным диабетом 2 типа имеют ожирение, однако возможно развитие заболевания у людей с нормальной массой тела. Это связано с тем, что действие инсулина коррелирует не с общим количеством жировой ткани, а с ее распределением, то есть с распределением по висцеральному типу. Именно висцеральные адипоциты имеют повышенную чувствительность к липолитическому действию катехоламинов и сниженную чувствительность к антилиполитическому действию инсулина. Все это приводит к усилению процесса липолиза и повышенному поступлению свободных жирных кислот в портальную систему. На уровне печени свободные жирные кислоты нарушают связывание инсулина с печеночными клетками, что способствует развитию системной гиперинсулинемии, усугубляет инсулинорезистентность гепатоцитов и препятствуют ингибирующему действию гормона на печеночный глюконеогенез и стимулирует гликогенолиз. Повышенный процесс гликогенолиза обуславливает постоянно повышенную продукцию глюкозы печенью. Кроме того, высокая концентрация свободных жирных кислот в крови вызывает инсулинорезистентность на уровне скелетных мышц, результатом чего является гипергликемия и компенсаторная гиперинсулинемия. Таким образом, формируется порочный круг инсулинорезистентность-гипергликемия-возрастающая гиперинсулинемия- усугубление инсулинорезистентности. Компенсаторные возможности организма, по-видимому ограничены и компенсировать инсулинорезистентность после определенного периода скрытого течения патологии уже не способны. Возможно развитие инсулинорезистентности у здоровых людей, однако это далеко не у всех приводит к гипергликемии. Последняя возникает при снижении секреции инсулина, то есть сахарный диабет развивается при двух одномоментно протекающих процесса: инсулинорезистентности и нарушение функции β-клеток. Таким образом, инсулинорезистентность еще не означает обязательного развития сахарного диабета 2 типа, для возникновения которого необходим относительный дефицит секреции инсулина.
Резистентность к инсулину может уменьшиться в результате снижения веса и/или фармакотерапии гипергликемии, однако она редко восстанавливается до нормальной. Она возникает чаще у женщин с предшествовавшим сахарным диабетом беременных и у пациентов с гипертонией и дислипидемией, ее частота варьирует в разных расовых и этнических подгруппах. Некоторые характеристики сахарного диабета I и II типов представлены в таблице 7. Жизненно важно обращать внимание не только на обмен глюкозы, но и на ожирение, гипертонию, нарушение липидного обмена, курение, сердечно-сосудистую патологию, инфекции, побочные эффекты терапии.
Таблица 7.
| Основные признаки сахарного диабета I и II типов | ||
| Признак | I тип (ИЗСД) | II тип (ИНСД) |
| преобладание | 0,2-0,5 %, оба пола поражаются одинаково | 2-4 %, женщины болеют чаще мужчин |
| возраст возникновения болезни | дети, молодые люди | старше 40 лет |
| развитие симптомов | острое | постепенное (месяцы, годы) |
| телосложение | худые | часто ожирение |
| потеря веса при заболевании | как правило, происходит | похудение очень редко |
| запах кетонов изо рта | бывает часто | обычно запаха нет |
| моча | глюкоза и ацетон | глюкоза |
| концентрация инсулина в плазме | низкая или не определяется | часто нормальная; может быть повышенная |
| антитела к островковым клеткам | присутствуют | отсутствуют |
| наследственность | поражено <10% родственников I степени родства, конкордантность среди идентичных близнецов 30-50 % | поражено >20% родственников I степени родства, конкордантность среди близнецов 90-100 % |
| ассоциация с HLA | B8, B15, Dw3, Dw4, DR3, DR4 | нет ассоциации |
| лечение (основное) | инсулин | диета, физическая нагрузка, сахароснижающие препараты, инсулин. |
Метаболический синдром Х. Инсулинорезистентность сочетается с рядом метаболических или сосудистых заболеваний. Одним из таких заболеваний является сидром Х или метаболический синдром. Метаболический синдром характеризуется сочетанием нарушенной толерантностью к глюкозе или СД II типа, гипертонической болезни (АД > 140/90 мм Нg), ишемической болезни сердца (ИБС), ожирения абдоминального типа, гиперинсулинемией, гиперурикемией (мочевая кислота > 476 мкмоль/л), дислипидемией (холестерин > 6,5 ммоль/л, холестерин-ЛПВП < 0,9 ммоль/л, триглицериды > 2,3 ммоль/л). Кроме того, в сывоотке содержание фибриногена выше 3 г/л (норма 2-4 г/л), имеет место альбуминурия (> 20 мг/л мочи). Основной причиной инсулинорезистентности является периферическая нечувствительность инсулин-зависимых тканей (печень, мышцы, жировая ткань) к гормону. Инсулин оказывает свое действие на клетки этих тканей путем связывания со специфическими рецепторами на клеточной мембране. При этом запускается ряд внутриклеточных процессов, направленных на захват глюкозы клеткой (фосфорилирование белков-транспортеров) и внутриклеточный метаболизм глюкозы. Резистентность может проявляться на рецепторном и пострецепторном уровнях. Поскольку клетки инсулинзависимых тканей испытывают энергетический голод, происходит усиленный синтез инсулина (гиперинсулинемия). При этом инсулин вначале продуцируется в нормальном или избыточном количестве, однако хроническая гипергликемия сохраняется и может привести к нарушению функции b-клеток путем их истощения, поэтому предложен термин «глюкотоксичность», который отражает влияние гипергликемии в развитии СД II типа.
Ранняя диагностика синдрома инсулинорезистентности может помочь в профилактике и лечении СД II типа и его осложнений. Проводить обследование на инсулинорезистентность необходимо при наличии факторов риска у пациентов (гипертоническая болезнь, ИБС у родителей, ожирение, индекс массы тела более 30 кг/м2 поверхности тела, увеличение триглицеридов, снижение ЛПВП).
Для определения наличия и степени выраженности инсулинорезистентности применяется несколько методик:
· Эугликемическая клэмп методика с использованием биостатора.
· Определение коэффициента инсулинорезистентности по Каро – отношение базальной концентрации имунореактивного инсулина в сыворотке крови к содержанию глюкозы натощак.
· Определение индекса инсулинорезистентности по Дункан:
Индекс инсулинорезистентности = (гликемия натощак) х (базальный уровень ИРИ): 25.
· Оценка снижения уровня глюкозы в крови в ответ на в/в введение инсулина (проба с инсулином из расчета 0,1 ед. инсулина на 1 кг массы тела)
· Определение гиперинсулинемии при базальных условиях и при проведения теста толерантности к глюкозе (ТТГ). В ТТГ проводят определение инсулина и С-пептида натощак и через 2 ч после дачи 75 г глюкозы. Даже при нормальном ответе со стороны глюкозы в ТТГ существенное увеличение инсулина и С-пептида свидетельствует о наличии инсулинорезистентности.

Рис. 13. Алгоритм диагностики метаболического синдрома.
Date: 2015-07-17; view: 4046; Нарушение авторских прав