
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Первое начало термодинамики
|
|
Первое начало термодинамики утверждает, что изменение внутренней энергии термодинамической системы (тела) может быть осуществлено двумя путями: путём совершения механической работы и путём теплопередачи. Энергия, переданная системе путём теплопередачи, называется количеством теплоты.
Таким образом, количество теплоты может быть определено как разность изменения внутренней энергии системы и механической работы, совершённой над системой:
 , ,
| (1.1) |
где  – количество теплоты, переданной системе,
– количество теплоты, переданной системе,  – изменение внутренней энергии системы при её переходе из первого состояния во второе,
– изменение внутренней энергии системы при её переходе из первого состояния во второе,  – работа, совершённая над системой.
– работа, совершённая над системой.
Так как работа, совершенная над системой  , равна работе, совершенной системой
, равна работе, совершенной системой 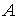 , взятой с обратным знаком:
, взятой с обратным знаком:  , то первое начало термодинамики может быть сформулировано следующим образом:
, то первое начало термодинамики может быть сформулировано следующим образом:
Теплота  , подводимая к системе, идет на изменение ее внутренней энергии
, подводимая к системе, идет на изменение ее внутренней энергии  и на совершение этой системой работы
и на совершение этой системой работы 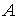 над внешними телами:
над внешними телами:
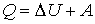 . .
| (1.2) |
Если к термодинамической системе подводится элементарное количество теплоты  , то оно расходуется на изменение внутренней энергии
, то оно расходуется на изменение внутренней энергии  и совершение элементарной работы
и совершение элементарной работы 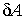 :
:
 . .
| (1.3) |
Отметим принципиальное отличие величины  и величин
и величин  и
и 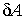 . Величина
. Величина  представляет собой полный дифференциал, то есть бесконечно малое изменение величины
представляет собой полный дифференциал, то есть бесконечно малое изменение величины  , и поэтому интеграл от неё равен разности внутренних энергий системы в двух состояниях, конечном и начальном:
, и поэтому интеграл от неё равен разности внутренних энергий системы в двух состояниях, конечном и начальном:
 . .
| (1.4) |
Интегралы (суммы) от малых величин  и
и 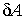 являются количеством теплоты
являются количеством теплоты  , переданной системе, и работой
, переданной системе, и работой  , совершенной системой при ее переходе из первого состояния во второе:
, совершенной системой при ее переходе из первого состояния во второе:
 , ,
| (1.5) |
 . .
| (1.6) |
В отличие от внутренней энергии, являющейся функцией состояния, теплота и работа функциями состояния не являются, а зависят от того, каким образом система переведена из одного состояния в другое.
С учетом формул (1.4) - (1.6) интегрирование выражения (1.3) дает
 . .
| (1.7) |
Эта формула представляет собой запись первого начала термодинамики применительно к случаю перехода термодинамической системы из некоторого первого состояния во второе.
По своему физическому смыслу первое начало термодинамики представляет собой закон сохранения (изменения) энергии в термодинамике. Если, согласно закону изменения энергии в механике, работа неконсервативных сил равна приращению механической энергии системы (в частности, имеющая отрицательный знак работа сил трения равна уменьшению механической энергии системы), то согласно первому началу термодинамики, приращение внутренней энергии термодинамической системы равно сумме работы внешних сил, совершенной над системой, и энергии, переданной системе путём теплопередачи.
В случае, если термодинамические процессы в системе квазиравновесные, и потоки энергии, вещества и т.д. в ней отсутствуют, то можно пренебречь внутренним трением, считая, что изменения объёма и давления определяют изменение состояния системы.
Работа  , совершаемая телом (например, газом) над внешними телами при перемещении элемента поверхности этого тела (оболочки газа), площадью
, совершаемая телом (например, газом) над внешними телами при перемещении элемента поверхности этого тела (оболочки газа), площадью 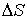 , на расстояние
, на расстояние  вдоль нормали к поверхности равна:
вдоль нормали к поверхности равна:
 , ,
| (1.8) |
где:  - сила, действующая по нормали к поверхности
- сила, действующая по нормали к поверхности 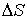 ,
,  – внешнее давление, которое считается неизменным при перемещении элемента
– внешнее давление, которое считается неизменным при перемещении элемента 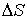 на расстояние
на расстояние  . Если давление
. Если давление  одно и то же во всех точках поверхности тела, то, просуммировав по всей поверхности, получим:
одно и то же во всех точках поверхности тела, то, просуммировав по всей поверхности, получим:
 , ,
| (1.9) |
где  – работа, совершённая телом при приращении его объёма на малую величину
– работа, совершённая телом при приращении его объёма на малую величину  (см. рис. 1.1).
(см. рис. 1.1).

|
| Рис. 1.1. Иллюстрация к расчету элементарной работы при изменении объема тела |
Для элементарной работы 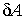 выражение (1.9) принимает вид:
выражение (1.9) принимает вид:
 . .
| (1.10) |
Работа при конечных изменениях объёма тела может быть определена путем интегрирования выражения (1.10):
 . .
| (1.11) |
Этот интеграл зависит от пути перехода из состояния с объемом  в состояние с объемом
в состояние с объемом  , так как функция
, так как функция  может иметь различный вид.
может иметь различный вид.
Рис. 1.2 иллюстрирует зависимость величины интеграла (1.11), численно равного площади под кривой  , от вида функции
, от вида функции  .
.

|
| Рис. 1.2. Работа при переходе из одного состояния термодинамической системы в другое |
В зависимости от траектории I или II перехода из первого состояния во второе, площадь под кривой  будет различна, а, следовательно, будет различна механическая работа, совершаемая системой в этих термодинамических процессах. Количество теплоты
будет различна, а, следовательно, будет различна механическая работа, совершаемая системой в этих термодинамических процессах. Количество теплоты  , необходимое для перехода из первого состояния во второе, также будет зависеть от вида кривой
, необходимое для перехода из первого состояния во второе, также будет зависеть от вида кривой  (формы траектории). В этом можно убедится, если учесть тот факт, что внутренняя энергия является функцией состояния термодинамической системы, и ее изменение при переходе из первого состояния во второе не зависит от пути этого перехода. А, следовательно, в соответствии с первым началом термодинамики (см. формулу (1.2)) теплота, также как и работа, должна зависеть от термодинамического процесса, с помощью которого производился переход термодинамической системы.
(формы траектории). В этом можно убедится, если учесть тот факт, что внутренняя энергия является функцией состояния термодинамической системы, и ее изменение при переходе из первого состояния во второе не зависит от пути этого перехода. А, следовательно, в соответствии с первым началом термодинамики (см. формулу (1.2)) теплота, также как и работа, должна зависеть от термодинамического процесса, с помощью которого производился переход термодинамической системы.
Задача 1.1. Найти работу, совершаемую газом, при его расширении от объема  до объема
до объема  , если зависимость давления
, если зависимость давления  от объема
от объема  выражается формулой:
выражается формулой:  , где
, где  и
и  - известные константы.
- известные константы.
Решение: В соответствии с формулой (1.11) имеем:

111. Адиабатический процесс. Уравнение Пуассона.
Адиабатный процесс. Уравнение Пуассона для адиабатного процесса. Уравнение адиабаты (уравнение Пуассона). Адиабатическим называется процесс, происходящий без теплообмена с окружающей средой. Следовательно, для него характерно наличие хорошей изоляции ТС от внешней среды или высокая скорость термодинамического процесса, при которой теплообмен незначителен. Поскольку обратимые процессы, в отличии от адиабатных, являются бесконечно медленными, то о равновесности последних можно говорить только применительно к определенным областям ТС. Поскольку для адиабатического процесса dQ = 0, то dA = - dU. Следовательно, p·dV = - (m/m)·Cv·dT. (13.18) Следовательно, работа газа при адиабатическом расширении равна A1-2 = (m/m)·Cv·(T1 - T2). (13.19) Выразив величину P из уравнения Менделеева-Клапейрона и подставив ее в (13.18), после соответствующих преобразований получим уравнение адиабаты: T·Vg-1 = const или p·Vg = const. (13.20) Уравнение (13.20) называется также уравнением Пуассона. На диаграмме P-V адиабата испытывает более резкое падание, чем изотерма (см. рис. 13.4), т.е. в любой точке кривой модуль производной от давления по объему для нее больше. Действительно, из уравнения адиабаты можно показать, что dp/dV = - g·p/V > p/V.
Date: 2016-07-22; view: 297; Нарушение авторских прав