
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Первый закон термодинамики
|
|
Изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
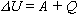
Этот закон можно сформулировать иначе:
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
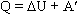
В первой формулировке А - работа, совершаемая над системой (над газом), во второй А' - это работа, совершаемая системой (газом).
Вечный двигатель первого рода - устройство, способное совершать неограниченное количество работы без подведения энергии извне.
Из первого закона термодинамики следует невозможность создания вечного двигателя первого рода. Если к системе не поступает теплота, то
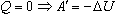
Иными словами, работа совершается системой за счет уменьшения ее внутренней энергии. После того, как запас энергии будет исчерпан, двигатель перестанет работать.
Процесс, протекающий в теплоизолированной системе, называют адиабатным.

Абсолютно исключить теплопередачу невозможно, но иногда реальные процессы близки к адиабатным. Они протекают за очень малый промежуток времени, в течение которого не происходит существенного теплообмена между системой и внешними телами.
ТЕПЛОВЫЕ ДВИГАТЕЛИ
Тепловые двигатели - устройства, превращающие внутреннюю энергию топлива в механическую энергию.
Любой тепловой двигатель состоит из трех основных частей.
Рабочее тело - газ, совершающий работу А' при расширении.
Нагреватель - устройство, от которого рабочее тело получает количество теплоты Q 1
Холодильник - устройство, которому рабочее тело передает количество теплоты Q2
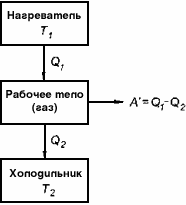
Коэффициентом полезного действия (КПД) теплового двигателя называют отношение работы,совершаемой двигателем, к количеству теплоты, полученному от нагревателя:
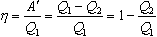
Так как Q2 < Q1, то 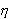 всегда < 1.
всегда < 1.
Идеальная тепловая машина Карно - модель теплового двигателя, в котором рабочим телом является идеальный газ. КПД машины Карно

где Т1 - температура нагревателя, T2 - температура холодильника.
Реальная тепловая машина не может иметь КПД, превышающий КПД идеальной тепловой машины.
Пример. Объем кислорода массой 160 г, температура которого 27°С, при изобарном нагревании увеличился вдвое. Найдите работу газа при расширении, количество теплоты, которое пошло на нагревание кислорода, изменение внутренней энергии.
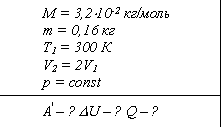

Величина работы, совершаемой газом при изобарном процессе, когда V = V2 - V1 = V1, определяется выражением
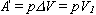
С учетом уравнения состояния
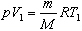
можно записать
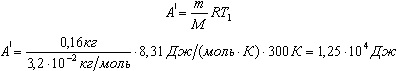
Изменение внутренней энергии двухатомного газа, с учетом уравнения состояния, будет выглядеть:
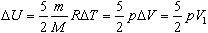
Учитывая, что А| = pV1, получим: 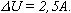
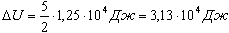
Количество теплоты, переданное газу, согласно первому закону термодинамики, идет на изменение его внутренней энергии и совершение газом работы:
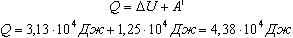
Ответ: работа газа равна 12,5 кДж, количество теплоты, которое пошло на его нагревание, равно 43,8 кДж, изменение внутренней энергии - 31,3 кДж.
110. Первое начало термодинамики.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.
Первое начало термодинамики представляет собой закон сохранения энергии, один из всеобщих законов природы (наряду с законами сохранения импульса, заряда и симметрии):
Энергия неуничтожаема и несотворяема; она может только переходить из одной формы в другую в эквивалентных соотношениях.
Первое начало термодинамики представляет собой постулат - оно не может быть доказано логическим путем или выведено из каких-либо более общих положений. Истинность этого постулата подтверждается тем, что ни одно из его следствий не находится в противоречии с опытом. Приведем еще некоторые формулировки первого начала термодинамики:
Полная энергия изолированной системы постоянна;
Невозможен вечный двигатель первого рода (двигатель, совершающий работу без затраты энергии).
Первое начало термодинамики устанавливает соотношение между теплотой Q, работой А и изменением внутренней энергии системы ∆U:
Изменение внутренней энергии системы равно количеству сообщенной системе теплоты минус количество работы, совершенной системой против внешних сил.
∆U = Q-A (1.1)
dU = δQ-δA (1.2)
Уравнение (1.1) является математической записью 1-го начала термодинамики для конечного, уравнение (1.2) - для бесконечно малого изменения состояния системы.
Внутренняя энергия является функцией состояния; это означает, что изменение внутренней энергии ∆U не зависит от пути перехода системы из состояния 1 в состояние 2 и равно разности величин внутренней энергии U2 и U1 в этих состояниях:
∆U = U2-U1 (1.3)
Следует отметить, что определить абсолютное значение внутренней энергии системы невозможно; термодинамику интересует лишь изменение внутренней энергии в ходе какого-либо процесса.
Рассмотрим приложение первого начала термодинамики для определения работы, совершаемой системой при различных термодинамических процессах (мы будем рассматривать простейший случай - работу расширения идеального газа).
Изохорный процесс (V = const; ∆V = 0).
Поскольку работа расширения равна произведению давления и изменения объема, для изохорного процесса получаем:
| ∆U = Q-A | 1.1 |
| A=P∆V=0 | I.4 |
| ∆U = QV | I.5 |
| Т.е., приращение внутренней энергии равно количеству теплоты, поглощенной при постоянном объеме. | |
Изотермический процесс (Т = const).
Из уравнения состояния одного моля идеального газа получаем:
Р =  (I.6)
(I.6)
Отсюда:
δА = PdV = RT 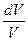 (I.7)
(I.7)
Проинтегрировав выражение (I.6) от V1 до V2, получим
A=  RT
RT 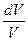 = RTln
= RTln 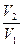 = RTln
= RTln  (1.8)
(1.8)
Изобарный процесс (Р = const).
∆U = Q-A
A= P∆V
Qp = ∆U + P∆V (1.12)
В уравнении (1.12) сгруппируем переменные с одинаковыми индексами. Получаем:
Qp = U2-U1 +P(V2-V1) = (U2 + PV2)-(U1 +PV1) (1.13)
Введем новую функцию состояния системы - энтальпию Н, тождественно равную сумме внутренней энергии и произведения давления на объем: Н = U + PV. Тогда выражение (1.13) преобразуется к следующему виду:
Qp = H2-H1= ∆ H (1.14)
Т.о., тепловой эффект изобарного процесса равен изменению энтальпии системы.
Адиабатический процесс (Q = 0, δQ = 0).
При адиабатическом процессе работа расширения совершается за счёт уменьшения внутренней энергии газа:
A = - 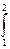 dU=
dU= 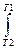 CvdT (1.15)
CvdT (1.15)
В случае если Сv не зависит от температуры (что справедливо для многих реальных газов), работа, произведённая газом при его адиабатическом расширении, прямо пропорциональна разности температур:
A = -CV∆T (1.16)
Задача №1. Найти изменение внутренней энергии при испарении 20 г этанола при температуре его кипения. Удельная теплота парообразования этилового спирта при этой температуре составляет 858,95 Дж/г, удельный объем пара – 607 см3/г (объемом жидкости пренебречь).
Решение:
1. Вычислим теплоту испарения 20 г этанола: Q=qуд·m=858,95Дж/г·20г = 17179Дж.
2. Вычислим работу по изменению объема 20 г спирта при переходе его из жидкого состояния в парообразное: A= P∆V,
где Р – давление паров спирта, равно атмосферному, 101325 Па (т.к. всякая жидкость кипит, когда давление ее паров равно атмосферному).
∆V=V2-V1=Vж-Vп, т.к. Vж<< Vп, то объмом жидкости можно пренебречь и тогда Vп=Vуд·m. Cледовательно, А=Р·Vуд·m. А=-101325Па·607·10-6м3/г·20г=-1230 Дж
3. Вычислим изменение внутренней энергии:
∆U=17179Дж – 1230 Дж = 15949 Дж.
Поскольку ∆U>0, то следовательно при испарении этанола происходит увеличение внутренней энергии спирта.
Date: 2016-07-22; view: 755; Нарушение авторских прав