
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Принципы заполнения многоэлектронных атомов. Электронные атомы
|
|
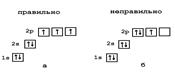
Порядок заполнения орбиталей на первых, наиболее близких к ядру электронных уровнях атома. Заполнение электронами происходит снизу вверх. Справа показано наибольшее количество электронов, способных разместиться на орбиталях данного подуровня. 4-й уровень показан не полностью.
Чем дальше от ядра располагаются уровни и подуровни, тем выше их энергия. По некоторым причинам 4s-подуровень большинства атомов заполняется электронами раньше, чем 3d-подуровень. Такие аномалии встречаются и на более высоких уровнях. Вот как выглядит порядок заполнения уровней и подуровней в атомах большинства элементов:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d,...
Правила заполнения электронных оболочек следующие:
1. Сначала выясняем, сколько всего электронов содержит атом интересующего нас элемента. Для этого достаточно знать заряд его ядра (всегда равен порядковому номеру элемента)
2. Последовательно заполняем орбитали, начиная с нижней 1s-орбитали, имеющимися электронами. При этом нельзя располагать на каждой орбитали более двух электронов.
3. Записываем электронную формулу элемента.
Электронная формула описывает распределение электронов по энергетическим уровням, существующим в электронном облаке. Такое распределение называется также электронной конфигурацией атома.
По правилу Гунда при заполнении электронами одинаковых орбиталей электроны располагаются в первую очередь по одиночке на каждой орбитали, и лишь потом начинается заселение этих орбиталей вторыми электронами. Когда орбиталь заселяется двумя электронами, такие электроны называют спаренными, а одиночные- неспаренными.
Вопрос 11
Периодического закона: «…свойства элементов, а также свойства образуемых ими простых и сложных вещ-в, стоят в периодической зависимости от их атомного веса». В периодической системе в группах слева направо ослабляются основные свойства, усиливаются-кислотные. Сверху вниз в группах усиливаются основные, ослабляются кислотные.
Вопрос 16
Date: 2016-07-20; view: 638; Нарушение авторских прав