
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Внутренняя энергия идеального газа. Первый закон термодинамики
|
|
Термодинамика – это теория тепловых явлений, в которой не учитывается атомно-молекулярное строение тел. Для описания явлений в термодинамике используются понятия «термодинамическая система» и «термодинамический процесс». Совокупность физических тел, изолированных от взаимодействия с другими телами, называют изолированной термодинамической системой.
Любое изменение, происходящее в термодинамической системе, называется термодинамическим процессом.
Тело, как система из составляющих его частиц обладает внутренней энергией. С позиций молекулярно-кинетической теории внутренняя энергия – это сумма потенциальной энергии взаимодействия частиц, составляющих тело, и кинетической энергии их беспорядочного теплового движения.
Кинетическая энергия беспорядочного движения частиц пропорциональна температуре, потенциальная энергия взаимодействия зависит от расстояний между частицами, т.е. от объема тела. Поэтому в термодинамике внутренняя энергия тела определяется как функция его макроскопических параметров, например, температуры и его объема:
 .
.
Вычислим внутреннюю энергию идеального газа. Если потенциальная энергия взаимодействия молекул равна нулю, внутренняя энергия идеального газа равна сумме кинетических энергий хаотического теплового движения всех его молекул:
 .
.
Данное выражение справедливо для одноатомного газа. В общем случае внутренняя энергия газа определяется числом степеней свободы молекул i:
 .
.
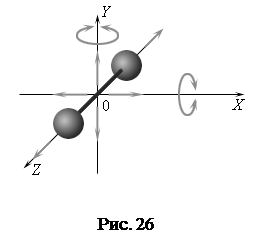
Так, одноатомная молекула обладает тремя степенями свободы поступательного движения (i = 3); двухатомная (рис. 26) – тремя степенями свободы поступательного движения и двумя вращательного движения (i = 5).
Внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре. Следовательно, при изменении температуры идеального газа обязательно изменяется его внутренняя энергия.
Внутренняя энергия тела может изменяться только в результате его взаимодействия с другими телами. При механическом взаимодействии тел мерой энергии, переданной от одного тела к другому, является работа А. При осуществлении теплопередачи от одного тела к другому, мерой переданной энергии является количество теплоты Q. Совершение механической работы называется макроскопическим способом передачи энергии, а теплопередача – микроскопическим.
Термодинамика построена в основном на двух фундаментальных законах, полученных из многовекового опыта человеческой деятельности и называемых началами термодинамики. Первое начало описывает количественную и качественную стороны процессов превращения энергии; второе начало позволяет судить о направлении этих процессов.
Рассмотрим три тела – 1, 2, и 3. Пусть между телом 1 и телом 2 осуществляется теплопередача, а между телом 1 и телом 3 происходит механическое взаимодействие. При теплопередаче количества теплоты Q внутренняя энергия тела 2 изменится на ΔU2=- Q, а внутренняя энергия тела 3 в результате совершения работы изменится на ΔU3=-А. В результате теплопередачи и механического взаимодействия внутренняя энергия каждого из трех тел изменится, но в изолированной термодинамической системе, в которую входят все три тела, по закону сохранения и превращения энергии внутренняя энергия U остается неизменной. Следовательно, сумма изменений внутренней энергии тел 1, 2 и 3 равна нулю:
 .
.
Отсюда изменение внутренней энергии тела 1 равно сумме изменений внутренней энергии взаимодействующих с ним тел 2 и 3, взятой с противоположным знаком:

или
 .
.
Так как тело 1 является неизолированной термодинамической системой, можно сделать общий вывод: в неизолированной термодинамической системе изменение внутренней энергии ΔU равно сумме количества теплоты Q, переданного системе, и работы А внешних сил над этой системой:
 .
.
Это выражение закона сохранения и превращения энергии называется первым законом термодинамики.
Вместо работы А, совершаемой внешними силами над термодинамической системой, часто удобнее бывает рассматривать работу А*, совершаемую термодинамической системой над внешними телами. Так как эти работы равны по абсолютному значению, но противоположны по знаку:
 ,
,
то первый закон термодинамики имеет второе выражение:
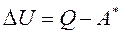 .
.
В неизолированной термодинамической системе изменение внутренней энергии ΔU равно разности между полученным количеством теплоты Q и работой А*, совершаемой системой.
Если система периодически возвращается в исходное состояние, то изменение ее внутренней энергии ΔU=0. Тогда, согласно первому началу термодинамики,
 .
.
Это означает, что невозможно создать периодически действующий механизм, который совершал бы работу, превышающую получаемую им энергию. Воображаемый механизм, совершающий работу, большую получаемой энергии, называется вечным двигателем первого рода. Поэтому первому началу термодинамики можно еще дать и такую формулировку: вечный двигатель первого рода невозможен. В этой связи интересно отметить, что открытие первого начала термодинамики положило конец многочисленным, но бесплодным попыткам построить вечный двигатель.
Справедливость первого закона термодинамики для биологии можно доказать, если живой организм изолировать от окружающей среды, измерить количество выделенного им тепла и сравнить эту величину с тепловым эффектом биохимических реакций внутри организма. С этой целью еще в 1780 г. Лавуазье и Лаплас помещали морскую свинку в калориметр и измеряли количество выделенного тепла и углекислого газа. После этого определяли количество тепла, выделяющегося при прямом сжигании исходных продуктов питания. В обоих случаях получались близкие величины. Более точные результаты были получены при измерении количеств тепла, углекислоты, азота и мочевины, выделенных человеком. На основании этих данных вычисляли баланс обмена белков, жиров и углеводов. И здесь совпадение оказалось достаточно хорошим.
Date: 2016-11-17; view: 1226; Нарушение авторских прав