
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Реноваскулярная гипертония 2 page
более или 400%, если исходный показатель ниже 3 нг/мл/ч
Muller FB et al.: The captopril test for identifying renovascular disease in hypertensive patients. Am J Med 1986; 80:633.
Глава 45. Реноваскулярная гипертония
 Таблица 45.6. Раздельные катетеризационные пробы
Таблица 45.6. Раздельные катетеризационные пробы
Взятие крови (больной должен потреблять 40—100 ммоль натрия в сутки)
1. После пробуждения больного определяют активность ренина в плазме и суточную экскрецию натрия с мочой в обычных условиях (то есть не в день ангиографии)
2. Кровь берут до и после приема каптоприла
3. В положении больного лежа для определения активности ренина в плазме берут кровь из почечной вены на той стороне, где предполагается поражение почечной артерии (В1)а, и одновременно из аорты (А1) или нижней полой вены (НПВ1), а также почечной вены второй почки (В2), а также одновременно из аорты (А2) или нижней полой вены (НПВ2)
4. Если результат первого измерения активности ренина в плазме сомнителен, исследуют кровь, взятую после приема каптоприла
Критерии обратимости реноваскулярной гипертонии Активность ренина в плазме несоизмеримо высокая по отношению к уровню натрия в моче — признак гиперсекреции ренина
Существенное повышение активности ренина в плазме и снижение АД после приема каптоприла В2 — А2 к 0 — признак угнетения секреции ренина в здоровой почке
(В1 - А1)/А1 > 0,5 — признак односторонней секреции ренина и ишемии почки на стороне поражения Низкое отношение активности ренина в крови, взятой из почечной вены и аорты [(В1 - А1)/А1 + (В2 - А2)/А2 < 0,5], при высокой активности ренина в плазме — признак неправильного взятия крови или сегментарной гипоплазии. В таких случаях берут кровь из сегментарных почечных артерий и повторно определяют активность ренина в плазме
В — активность ренина в крови, взятой из почечной вены; А —
активность ренина в крови, взятой из аорты; НПВ — активность
ренина в крови, взятой из нижней полой вены.
а Поскольку активность ренина в крови, взятой из аорты или
нижней полой вены, одинакова, А и НПВ взаимозаменяемы
(Sealey, 1973).
Vaughan ED Jr: Renal artery stenosis. Chapter 10 in: Hypertension.
Vol 8 of: Contemporary Issues in Nephrology. Brenner BM, Stein JH
(eds). Churchill Livingstone, 1981.
нансной ангиографии с гадолинием и реконструкцией трехмерного изображения превышает 90% и, таким образом, превосходит таковые обычной ангиографии. Магнитно-резонансная ангиография особенно надежно выявляет поражение проксимальных участков почечной артерии. Поскольку магнитно-резонансная ангиография редко дает ложноотрицательные результаты, отсутствие изменений при ней исключает необходимость проведения обычной ангиографии у больных с высоким риском осложнений. Применение магнитно-резонансной ангиографии пока ограничено из-за высокой стоимости и отсутствия большого числа опытных специалистов. Спиральная КТ позволяет получать изображение не только тканей, но и сосудов. В отличие от обычной при спиральной КТ сканирующая система вращается гораздо быстрее, поэтому по мере прохождения рентгеноконтра-стного средства через артерии можно получать их изо-
бражение через очень небольшие временные интервалы. Разрешающая способность спиральной КТ примерно такая же, как у магнитно-резонансной ангиографии, хотя оба метода не способны выявлять добавочные почечные артерии. Главное преимущество в том, что при спиральной КТ можно одновременно получить трехмерное изображение аорты, почечных артерий и почек. Чувствительность и специфичность спиральной КТ в диагностике стеноза почечной артерии достигает 95%. Однако в отличие от магнитно-резонансной ангиографии оценить с ее помощью проходимость почечных артерий после установки стента невозможно. Главные недостатки спиральной КТ — высокая стоимость и необходимость введения большого количества рентге-ноконтрастного средства для получения изображения высокого качества (150 мл по сравнению с 15 мл, используемыми при цифровой субтракционный ангиографии), поэтому это исследование противопоказано при почечной недостаточности. Прочие исследования. Экскреторная урография для выявления реноваскулярной гипертонии не рекомендуется, так как чувствительность метода составляет 75%, а специфичность — 86%. Это исследование показано при подозрении на заболевания почек и мочевых путей, а также для диагностики пороков развития перед операцией.
Ангиография, в том числе цифровая субтракцион-ная, не имеет преимуществ перед описанными выше исследованиями (табл. 45.4). Во-первых, чтобы уточнить строение мочевых путей и почечных артерий при ангиографии, требуется в/в введение рентгеноконтра-стного средства. Во-вторых, стеноз почечной артерии, выявленный при ангиографии, не патогномоничен дтя реноваскулярной гипертонии, и без определения активности ренина в плазме или крови, взятой из почечной вены, нельзя утверждать, что причина артериальной гипертонии — именно ишемия почки.
Артериальная гипертония при заболеваниях почек
При подозрении на эту патологию активность ренина в плазме определяют так же, как у больных с предполагаемой реноваскулярной гипертонией. Кроме того, рекомендуется каптоприловая проба, в ходе которой активность ренина в плазме должна повыситься, а АД -снизиться. Хирургическое лечение при артериальной гипертонии, обусловленной заболеваниями почек, эффективно реже, чем при реноваскулярной гипертонии. Если эффективны гипотензивные средства или СКФ в пораженной почке достаточна, чтобы гарантировать жизнь больному на случай, когда потребуется удаление второй почки, нефрэктомию не выполняют.
ЛЕЧЕНИЕ
Лечение начинают, только убедившись в том, что артериальная гипертония действительно гиперрениновая,
Глава 45. Реноваскулярная гипертония
ибо другие формы артериальной гипертонии лечат иначе. Лечение подбирают индивидуально.
Существует три основных метода — медикаментозное лечение, баллонная ангиопластика (с установкой стента в почечную артерию или без нее) и реконструктивные сосудистые операции.
Медикаментозное лечение
До появления новейших гипотензивных средств медикаментозное лечение реноваскулярнои гипертонии было малоэффективным. Современные гипотензивные средства снижают АД, но не предотвращают прогрессирующее ухудшение функции почек, особенно при атеро-склеротическом поражении почечных артерий. Самые эффективные из гипотензивных средств — ингибиторы АПФ. Однако из-за устранения сосудосуживающего действия ангиотензина II на приносящие клубочковые артериолы может снижаться СКФ, а у больных с двусторонним поражением почечных артерий — даже возникать ОПН. У таких больных, а также при стенозе почечной артерии единственной почки ингибиторы АПФ могут повышать уровни креатинина сыворотки иАМК. Вдобавок стеноз почечной артерии — патология прогрессирующая, и у 15% больных даже на фоне нормального АД стеноз переходит в окклюзию. При реноваскулярнои гипертонии применяют и блокаторы ангиотензиновых рецепторов, хотя доказательств их эффективности пока мало. Антагонисты кальция расширяют приносящие клубочковые артериолы и снижают АД, влияя на функцию почек меньше, чем ингибиторы АПФ. В целом, медикаментозное лечение проводят, когда хирургическое вмешательство противопоказано им неэффективно. При этом обязателен контроль не только АД, но и функции почек.
Баллонная ангиопластика
Этот современный метод лечения (гл. 8) в случае успеха увеличивает просвет почечной артерии и снижает активность ренина в плазме (рис. 45.6—45.8). Показания к баллонной ангиопластике — фибромышечная диспла-зия и атеросклероз почечной артерии; противопоказания — поражение устья почечной артерии или ее окклюзия. Баллонная ангиопластика эффективна более чем у 80% больных. Она избавляет их от риска открытой операции и излечивает артериальную гипертонию без ущерба для функции почек, а порой и с ее улучшением. При фибромышечной дисплазии удовлетворительные результаты наблюдаются у 93% больных (у 58% — излечение, у 35% — улучшение). Повторный стеноз возникает редко. У больных с атеросклерозом почечной артерии баллонная ангиопластика эффективна в 80% случаев (у 22% — излечение, у 58% — улучшение). Рецидив стеноза через 9 мес и более после вмешательства возникает у 19% больных. Известно, что неудачный исход баллонной ангиопластики вовсе не предвещает, что открытая операция тоже будет неэффективной.
Установка стента в почечную артерию
Стент в почечную артерию устанавливают в конце баллонной ангиопластики, чтобы обеспечить проходимость почечной артерии. Показания включают стеноз устья почечной артерии, когда высок риск повторного стеноза. Стент можно устанавливать также после неудачной баллонной ангиопластики или при повторном стенозе. После баллонной ангиопластики и установки стента в почечную артерию повторный стеноз в группе риска возникает реже, чем после вмешательства без установки стента.

|

|
Рисунок 45.7. Селективные почечные артериограммы при стене Б. После баллонной ангиопластики. Vaughan ED Jr: Renal artery Vol 8 of: Contemporary Issues in Nephrology. Churchill Livingstone,
1зе правой почечной артерии. А. До баллонной ангиопластики, stenosis. Chapter 10 in: Hypertension. Brenner BM, Stein JH (eds). 1981.
Глава 45. Реноваскулярная гипертония
 | |||
 |

|
ния с использованием аутотрансплантата из большой подкожной вены ноги или внутренней подвздошной артерии, а также печеночно- или селезеночно-почечного шунтирования при тяжелом поражении аорты. Таким образом опытным хирургам удается излечить или уменьшить артериальную гипертонию у 90% тщательно отобранных больных; летальность составляет 2%. Результаты лучше при фибромышечной дисплазии, которая в отличие от атеросклероза в основном возникает у молодых больных без тяжелых сопутствующих заболеваний. Реконструктивные сосудистые операции все шире выполняют для сохранения функции почек у больных с ХПН на фоне поражения почечной артерии, даже в отсутствие артериальной гипертонии и при нормальной активности ренина в плазме. При азотемии неясной этиологии обязательно исключают поражение почечной артерии.
 Рисунок 45.8. Активность ренина в крови, взятой из почечной вены, после баллонной ангиопластики. Кровь брали перед, через 30 мин и 6 мес после операции. Кривая выше пунктирной линии отражает показатели для измененной почки, кривая ниже пунктирной линии — для здоровой. Пунктирной линией обозначена норма (V—А)/А = 0,24. Звездочками обозначены статистически значимые различия при сравнении активности ренина в крови, полученной из здоровой и измененной почки. Pickering TG et al.: Predictive value and changes of renin secretion in hypertensive patients with unilateral renovascular disease undergoing successful renal angioplasty. Am J Med 1984; 76:398.
Рисунок 45.8. Активность ренина в крови, взятой из почечной вены, после баллонной ангиопластики. Кровь брали перед, через 30 мин и 6 мес после операции. Кривая выше пунктирной линии отражает показатели для измененной почки, кривая ниже пунктирной линии — для здоровой. Пунктирной линией обозначена норма (V—А)/А = 0,24. Звездочками обозначены статистически значимые различия при сравнении активности ренина в крови, полученной из здоровой и измененной почки. Pickering TG et al.: Predictive value and changes of renin secretion in hypertensive patients with unilateral renovascular disease undergoing successful renal angioplasty. Am J Med 1984; 76:398.
Открытые операции
Показания к открытым операциям при реноваскуляр-ной гипертонии — окклюзия почечной артерии при сохранной функции почек, поражение устья почечной артерии, сложный стеноз и неэффективность баллонной ангиопластики. Первой успешной операцией при рено-васкулярной гипертонии была односторонняя нефрэк-томия. Но в целом, когда эту операцию проводили всем больным подряд, она излечивала только 26—37% из них. В настоящее время показаниями к односторонней нефр-эктомии считают артериальную гипертонию у больных с резко сниженной или отсутствующей функцией пораженной почки и нормально функционирующей второй почкой при неэффективности открытой реконструктивной операции, а также артериальную гипертонию у больных с высоким риском потери нефронов, когда снижение активности ренина в плазме может уменьшить этот риск. Если почку питает несколько почечных артерий, но только одна из них сужена, вместо нефрэк-томии приемлема резекция почки.
В настоящее время открытые операции выполняют прежде всего с целью сохранения функции почек. Ишемию почки можно устранить многими методами — с помощью эндартерэктомии, аортопочечного шунтирова-
ЛИТЕРАТУРА
Abdi A, Johns EJ: Importance of the renin-angiotensin system in the generation of kidney failure in renovascular hypertension. J Hypertens 1996; 14:1131.
Abdi A, Johns EJ: The effect of angiotensin II receptor antagonists on kidney function in two-kidney, two-clip Goldblatt hypertensive rats. Eur J Pharmacol 1997; 331:185.
Bedoya L et al.: The effect of baseline renal function on the outcome following renal revascularization. Cleve Clin J Med 1989; 56:415.
Beregi JP et al.: Helical CT angiography compared with arteriography in the detection of renal artery stenosis [see comments]. AJR 1996; 167:495.
Blaufox MD et al.: Cost efficacy of the diagnosis and therapy of renovascular hypertension. J Nucl Med 1996; 37:171.
Brunner HR et al.: Essential hypertension: Renin and aldosterone, heart attack, and stroke. N Engl J Med 1972; 286:441.
Brunner HR et al.: Hypertension of renal origin: Evidence for two different mechanisms. Science 1971; 174:1344.
Cragg AH et al.: Incidental fibromuscular dysplasia in potential renal donors: Long-term clinical follow-up. Radiology 1989; 172:145.
Davidson RA, Wilcox CS: New tests for the diagnosis of renovascular disease. JAMA 1992; 268:3353.
Elliott WJ, Martin WB, Murphy MB: Comparison of two noninvasive screening tests for renovascular hypertension. Arch Intern Med 1993; 153:755.
Eyler WR et al.: Angiography of the renal areas, including a comparative study of renal arterial stenosis in patients with and without hypertension. Radiology 1962; 78:879.
Frederickson ED et al.: A prospective evaluation of a simplified cap-topril test forthe detection of renovascular hypertension [see comments]. Arch Intern Med 1990; 150:569.
Gaul MK, Linn WD, Mulrow CD: Captopril-stimulated renin secretion in the diagnosis of renovascular hypertension. Am J Hypertens 1989; 2:335.
Gavras H et al.: Reciprocation of renin dependency in renal hypertension. Science 1979; 188:1316.
Goldblatt H, Lynch J, Hangel R: Studies on experimental hypertension. J Exp Med 1934; 59:347.
Gosse P et al.: Captopril test in the detection of renovascular hypertension in a population with low prevalence of the disease. A prospective study. Am J Hypertens 1989; 2:191.
Harvey RJ et al.: Screening for renovascular hypertension. JAMA 1985; 254:388.
Holley KE et al.: Renal artery stenosis: A clinical-pathologic study in normotensive patients. Am J Med 1964; 37:14.
Holm EA, Randlov A, Strandgaard S: Brief report: Acute renal failure after losartan treatment in a patient with bilateral renal artery stenosis. Blood Press 1996; 5:360.
Глава 45. Реноваскулярная гипертония
Howard JE et al.: Hypertension resulting from unilateral renovascular disease and its relief by nephrectomy. Bull Johns Hopkins Hosp 1954; 94:51.
Hunt JC, Strong CS: Renovascular hypertension: Mechanisms, natural history and treatment. Am J Cardiol 1973; 32:562.
Idrissi A et al.: The captopril challenge test as a screening test for renovascular hypertension. Kidney Int Suppl 1988; 25:S138.
Jacobson HR: Ischemic renal disease: An overlooked clinical entity. Kidney Int 1988; 34:729.
Jenni R et al.: Combined two-dimensional ultrasound Doppler technique. New possibilities for the screening of renovascular and parenchymatous hypertension? Nephron 1986; 44(Suppl 1):2.
Kohler TR et al.: Noninvasive diagnosis of renal artery stenosis by ultrasonic duplex scanning. J Vase Surg 1986; 4:450.
Kooner JS, Peart WS, Mathias CJ: The sympathetic nervous system in hypertension due to unilateral renal artery stenosis in man. Clin Auton Res 1991; 1:195.
Kutkuhn В et al.: Validity of the captopril test for identifying correctable unilateral renovascular hypertension. Clin Exp Hypertens (A) 1991; 13:143.
Laragh JH, Brenner BM: Hypertension: Pathophysiology, Diagnosis mi Management. Raven Press, 1990.
Laragh JH, Sealy JE: The renin-angiotensin-aldosterone system and the renal regulation of sodium, potassium, and blood pressure homeostasis. In: Windhager ЕЕ (editor): Handbook ofPhysiology,section 8, vol. 2. Oxford Univ Press, 1992.
MacLeod M et al.: Renal artery stenosis managed by Pal-maz stent insertion: Technical and clinical outcome. J Hypertens 1995; 13:1791.
Mann SJ, Pickering TG: Detection of renovascular hypertension. State of the art: 1992 [see comments]. Ann Intern Med 1992; 117:845.
Maxwell MH, Lupu AN: Excretory urogram in renal arterial hypertension. J Urol 1968; 100:395.
Maxwell MH, LupuAN, KaufmanJJ: Individual kidney function tests in renal arterial hypertension. J Urol 1968; 100:384.
Maxwell MH, Lupu AN, Taplin GV: Radioisotope renogram in renal arterial hypertension. J Urol 1968; 100:376.
Miller ED Jr, Samuels Al, Haber E: Inhibition of angiotensin conversion in experimental renovascular hypertension. Science 1972; 177:1108.
Miyajima E et al.: Muscle sympathetic nerve activity in renovascular hypertension and primary hyperaldosteronism. Hypertension 1991; 17:1057.
Muller FB et al.: The captopril test for identifying renovascular disease in hypertensive patients. Am J Med 1986; 80:633.
Nakamoto H et al.: Angiotensin-(1-7) and nitric oxide interaction in renovascular hypertension. Hypertension 1995; 25:796.
Novick AC: Selection of patients with atherosclerosis for renal reconstruction to preserve renal function. World J Urol 1989; 7:98.
Novick AC et al.: Diminished operative morbidity and mortality following revascularization for atherosclerotic renovascular disease. JAMA 1981; 246:749.
Olbricht CJ et al.: Minimally invasive diagnosis of renal artery stenosis by spiral computed tomography angiography. Kidney Int 1995; 48:1332.
Pickering TG: Medical management of renovascular hypertension. World J Urol 1989; 7:77.
Pickering TG et al.: Predictive value and changes of renin secretion in hypertensive patients with unilateral renovascular disease undergoing successful renal angioplasty. Am J Med 1984; 76:398.
Pickering TG, Mann SJ: Is there a role for non-invasive screening tests in diagnosing renal artery stenosis? (Editorial.) J Hypertens 1996; 14:1265.
Plouin PF et al.: Restenosis after a first percutaneous transluminal renal angioplasty. Hypertension 1993; 21:89.
Postma CT et al.: The captopril test in the detection of renovascular disease in hypertensive patients [see comments]. Arch Intern Med 1990; 150:625.
Prince MR et al.: Hemodynamically significant atherosclerotic renal artery stenosis: MR angiographic features. Radiology 1997; 205:128.
Ratliff NB: Renal vascular disease: pathology of large blood vessel disease. In: Porush JG (editor): Hypertension and the Kidney. Grune and Stratton, 1985.
Rees CR et al.: Palmaz stent in atherosclerotic stenoses involving the ostia of the renal arteries: Preliminary report of a multicenter study. Radiology 1991; 181:507.
Rene PC et al.: Renal artery stenosis: Evaluation of Doppler US after inhibition of angiotensin-converting enzyme with captopril [see comments]. Radiology 1995; 196:675.
Ribstein J, Mourad G, Mimran A: Contrasting acute effects of captopril and nifedipine on renal function in renovascular hypertension. Am J Hypertens 1988; 1:239.
Schreiber MJ, Novick AC, Pohl MA: The natural history of atherosclerotic and fibrous renal artery disease. World J Urol 1989; 7:59.
Sealey JE et al.: On the renal basis for essential hypertension: Nephron heterogeneity with discordant renin secretion and sodium excretion causing a hypertensive vasoconstriction-volume relationship. J Hypertens 1988; 6:763.
Sealey JE et al.: The physiology of renin secretion in essential hypertension: Estimation of renin secretion rate and renal plasma flow from peripheral and renal vein renin levels. Am J Med 1973; 55:391.
Sinaiko AR, Wells TG: Childhood hypertension. In: Laragh JH, Brenner BM (eds): Hypertension: Pathophysiology, Diagnosis, and Management. Raven Press, 1990.
Sos ТА et al.: Percutaneous transluminal renal angioplasty in renovascular hypertension due to atheroma or fibromuscular dysplasia. N Engl J Med 1983; 309:274.
Svetkey LP et al.: Prospective analysis of strategies for diagnosing renovascular hypertension. Hypertension 1989; 14:247.
Textor SC, Novick AC, Tarazi RC: Critical perfusion pressure for renal function in patients with bilateral atherosclerotic renal vascular disease. Ann Intern Med 1985; 120:308.
Update of the working group reports on chronic renal failure and renovascular hypertension. National High Blood Pressure Education Program Working Group. Arch Intern Med 1996; 156:1938.
Vaughan ED Jr et al.: Hypertension and unilateral parenchymal renal disease: Evidence for abnormal vasoconstriction-volume interaction. JAMA 1975; 233:1177.
Vaughan ED Jretal.: Renovascular hypertension: Renin measurements to indicate hypersecretion and contralateral suppression, estimate renal plasma flow, and score for surgical curability. Am J Med 1973; 55:402.
Vaughan ED Jr, Sosa RE: Renovascular hypertension. In: Walsh PC et al. (eds): Campbell's Urology, 6th ed. Saunders, 1992.
Veglio F et al.: Assessment of renal resistance index after captopril test by Doppler in essential and renovascular hypertension. Kidney Int 1995; 48:1611.
Wilcox GF, Smith TP, Fredrickson ED: Captopril glomerular filtration rate renogram in renovascular hypertension. ClinNucl Med 1989; 14:1.
 46 П. Турек
46 П. Турек
МУЖСКОЕ БЕСПЛОДИЕ
Бесплодием называют отсутствие зачатия в течение 1 года регулярной половой жизни без контрацепции. Бесплодием страдает около 15% супружеских пар. Примерно 40% случаев приходится на мужское бесплодие, 40% — на женское, еще 20% — на смешанное. При подозрении на мужское бесплодие обследование проводят по определенной схеме. Прежде чем обсуждать диагностику и лечение мужского бесплодия, следует рассмотреть физиологию репродуктивной системы.
ФИЗИОЛОГИЯ МУЖСКОЙ РЕПРОДУКТИВНОЙ СИСТЕМЫ
Гипоталамо - гипофизарно - гонадная система
Шаг вперед в понимании физиологии гипоталамо-ги-пофизарно-гонадной системы помогли сделать исследования с использованием гормонов, полученных из головного мозга домашнего скота в 1950-х гг., а позже — использование радиоиммунологического анализа для точного измерения уровней гормонов. Гипоталамо-ги-пофизарно-гонадная система играет основную роль в репродуктивной функции, в частности в перечисленных ниже процессах.
1. Формирование фенотипического пола в эмбриогенезе.
2. Половое развитие.
3. Эндокринная функция яичка — секреция тестостерона.
4. Экзокринная функция яичка — сперматогенез. Ввиду той роли, которую играет гипоталамо-гипофи-зарно-гонадная система в нормальной репродуктивной функции и при ее нарушениях, понимание физиологии этой системы лежит в основе диагностики и лечения мужского бесплодия.
Общие сведения
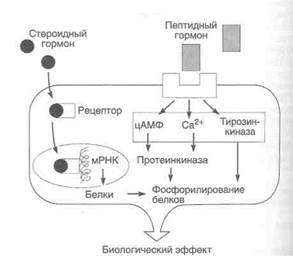
Классы гормонов. Межклеточные взаимодействия в органах, обеспечивающих репродуктивную функцию, происходят с участием двух классов гормонов — пептидных и стероидных. Пептидные гормоны — это небольшие сек-ретируемые белки, действующие на мембранные рецепторы. Действие этих гормонов реализуется с участием трех вторых (внутриклеточных) посредников (рис. 46.1). Благодаря им большинство пептидных гормонов стимулирует фосфорилирование различных белков, влияющих на функцию клетки. К пептидным гормонам относятся ЛГ и ФСГ.
В отличие от пептидных стероидные гормоны образуются из холестерина и не депонируются в секреторных гранулах, поэтому скорость выброса стероидных гормонов напрямую зависит от скорости их синтеза. В крови
эти гормоны, как правило, связываются с белками-переносчиками. Будучи липофильными, стероидные гормоны легко проникают через клеточную мембрану. После связывания с внутриклеточным рецептором стероидные гормоны переносятся в ядро и связываются со специфическими участками ДНК, регулирующими транскрипцию генов-мишеней. К стероидным гормонам относятся тестостерон и эстрадиол.
Определение уровней гормонов. Уровни гормонов определяют либо по их биологической активности (биологические методы), либо по связыванию с высокоаффинными антителами (иммуноферментные методы и радиоиммунологический анализ). Хотя биологические методы позволяют оценить активность того или иного гормона in vivo и in vitro, они трудоемки, а результат зависит от стабильности гормона в сыворотке. Иммуноферментные методы и радиоиммунологический анализ чувствительнее и занимают гораздо меньше времени, чем биологические, но они не позволяют оценить биологическую активность гормона. Отношение биологической активности к иммунореактивности гормона зависит от его концентрации, связывания с белками и состава субъединиц. Чаще всего уровни гонадотропных и половых гормонов определяют с помощью твердофазного имму-ноферментного анализа.
| Рисунок 46.1.Гормоны, участвующие в регуляции репродуктивной функции. |
Обратная связь. Для нормальной репродуктивной функции обязательно взаимодействие множества гормонов, а значит, нужна точная регуляция передачи сигнала. В ее основе лежит обратная связь, благодаря которой гормон регулирует синтез и активность не только самого себя, но и другогих гормонов. Вдобавок взаимное влияние гормонов обеспечивает то, что каждый из них действует на несколько мишеней и вызывает множество эффектов. Например, в гипоталамо-гипофизарно-го-надной системе отрицательная обратная связь проявля-
Глава 46. Мужское бесплодие
 ется угнетением секреции ЛГ в гипофизе при повышении в крови уровня тестостерона или эстрадиола. Итак, обратная связь — весьма чувствительный механизм, сводящий к минимуму случайные колебания уровней гормонов и поддерживающий гомеостаз.
ется угнетением секреции ЛГ в гипофизе при повышении в крови уровня тестостерона или эстрадиола. Итак, обратная связь — весьма чувствительный механизм, сводящий к минимуму случайные колебания уровней гормонов и поддерживающий гомеостаз.
Компоненты гипоталамо-гипофизарно-гонадной системы
Гипоталамус весит 4 г, расположен над зрительным перекрестом и образует дно III желудочка (рис. 46.2). Гипоталамус интегрирует информацию не только от гипотала-мо-гипофизарно-гонадной системы, но и из многих других отделов головного мозга (в том числе миндалевидного тела, таламуса, ствола и коры головного мозга) и сетчатки, а также обеспечивает импульсный выброс либеринов и статинов, в свою очередь, стимулирующих циклическую секрецию гипофизарных и половых гормонов. Гипоталамус связан с гипофизом воротной системой гипофиза и нейронами. Изолированная от системного кровотока, воротная система гипофиза обеспечивает прямое поступление гонадолиберина в аденогипофиз. Кроме того, с обратным током крови через эту систему гипофизарные гормоны попадают в гипоталамус.
Из всех либеринов и статинов в физиологии репродуктивной системы самую важную роль играет гонадо-либерин. Этот декапептид секретируют нейроны пре-оптических ядер и ядра воронки. На сегодняшний день известен единственный эффект гонадолиберина — стимуляция секреции ЛГ и ФСГ в аденогипофизе. Хотя помимо гипофиза гонадолиберин присутствует в разных отделах головного мозга и других органах, действует ли он на них, не установлено. Т|/2 гонадолиберина в воротной системе гипофиза составляет около 5—7 мин, причем гормон почти полностью исчезает из крови при первом прохождении через гипофиз за счет связывания с рецепторами или ферментативного расщепления.
Секреция гонадолиберина в гипоталамусе чувствительна к разным факторам. Среди них сигналы от высших отделов ЦНС в ответ на стресс, физическую нагрузку или изменение диеты, а также на уровни гонадо-тропных и половых гормонов в крови. Любопытно, что нервные окончания, из которых гонадолиберин высвобождается в гипоталамусе, находятся за пределами ге-матоэнцефалического барьера. Именно поэтому на ги-поталамо-гипофизарно-гонадную систему влияют циркулирующие гормоны. Вещества, которые влияют на секрецию гонадолиберина, перечислены в табл. 46.1. Самые значимые из них — половые гормоны.
Date: 2016-11-17; view: 308; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |