
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

СОСУДИСТО-ТРОМБОЦИТАРНОГО ГЕМОСТАЗА
|
|
Во многих клинических случаях диагностика конкретной причины кровоточивости, обусловленной дефектом сосудисто-тромбоцитарного гемостаза, достаточно сложна и в ряде случаев требует использования в диагностике сложных лабораторных методов исследования функции и микроструктур тромбоцитов, не нашедших пока широкого клинического применения. Тем не менее, при проведении диагностического поиска следует учитывать несколько важных принципов:
1. Обследование больных с повышенной кровоточивостью следует начинать с определения наиболее простых показателей: количества тромбоцитов в крови, их размеров, длительности кровотечения.
2. Если выявляется тромбоцитопения, первый этап дифференциальной диагностики должен быть направлен па исключение у больного аплазии кроветворения, гемобластозов, В|2-дефицитной анемии, болезни Маркиафавы-Микели, метастазов рака в костный мозг, а также ДВС-синдрома. С этой целью проводятся такие исследования как стернальная пункция, трепанобиопсия, гастродуоденоскопия, рентгенологическое исследование легких, УЗИ-исследовапие и др.
3. Если названная патология отсутствует, необходимо последовательно исключить возможность гетероиммунной формы заболевания (реакция на лекарственные препараты или па острую вирусную инфекцию) и симптоматических аутоиммунных форм заболевания, развившихся па фойе другого основного патологического процесса: системной красной волчанки, ревматоидного артрита, хронического лимфолейкоза, хронического активного гепатита, цирроза печени и др.
4. Если результат этого диагностического поиска оказались отрицательными, следует думать о возможной аутоиммунной идиопатической тромбоцитопенической пурпуре. В этих случаях диагноз подтверждается:
а) отсутствием признаков болезни в раннем детстве у пациента и у кровных родственников;
б) хорошим эффектом кортикостероидной терапии;
в) другими более сложными методами исследования функции тромбоцитов, например методом Диксона, в основе которого лежит количественное определение антител па поверхности тромбоцитов.
5. Если при подсчете тромбоцитов в крови их число оказалось нормальным, то с определенной долей вероятности следует проводить диагностический поиск заболеваний, в основе которых лежит нарушение функций тромбоцитов — тромбоцитопатий. С этой целью необходимо определить способность кровяных пластинок к адгезии и агрегации с различными стимуляторами (АДФ, адреналин, коллаген, бычий фибриноген и ристомицин). Ориоптируясь на данные, представленные в табл. 2, и учитывая результаты других клинических, лабораторных и инструментальных тестов, а также данные анамнеза, вполне возможна диагностика основных форм тромбоцитопатий.
6. При обнаружении признаков нарушенного высвобождения целесообразно прибегнуть к более сложным методам исследования, включая электронную микроскопию.
I II.КОАГУЛЯЦИОННЫЙ ГЕМОСТАЗ
Общие положения
|
 Вторичный, или коагуляционный, гемостаз обеспечивает плотную закупорку поврежденных сосудов красным тромбом, состоящим из сети волокон фибрина с захваченными ею клетками крови (тромбоцитами, эритроцитами и др.).
Вторичный, или коагуляционный, гемостаз обеспечивает плотную закупорку поврежденных сосудов красным тромбом, состоящим из сети волокон фибрина с захваченными ею клетками крови (тромбоцитами, эритроцитами и др.).
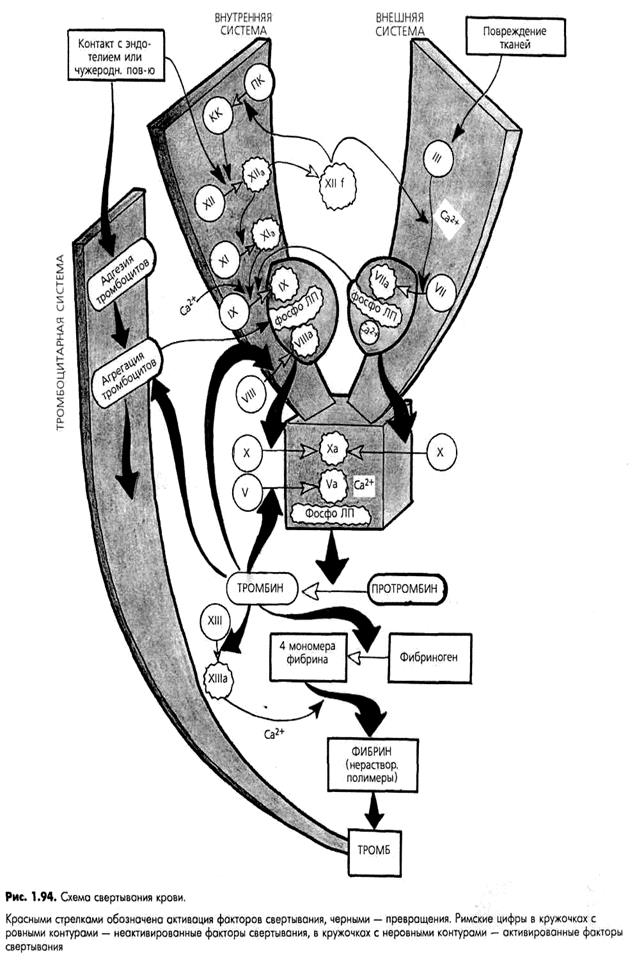
Упрощенная схема свертывания крови представлена на рис. 10. Под влиянием «активатора протромбина» — тромбокиназы, образующейся при повреждении тканей, агрегации и разрушении тромбоцитов, и в результате сложных химических взаимодействий факторов свертывания крови (см. ниже), белок плазмы протромбин превращается в тромбин, который, в свою очередь, расщепляет растворенный в плазме фибриноген с образованием фибрина. Волокна фибрина образуют основу тромба. Через несколько часов они активно сжимаются — происходит ретракция сгустка, в результате которой из него выдавливается светлая жидкость — сыворотка.
Свертывание крови в целом представляет собой многоступенчатый каскадный процесс, протекающий с участием многочисленных факторов свертывания. Все факторы присутствуют в плазме в неактивной форме. Они обозначаются римскими цифрами и соответствующими названиями (табл. 3), в которых отражена их функция (например, фактор XI — плазменный предшественник тромбопластина), фамилии больных с впервые обнаруженным у них дефицитом того или иного фактора (фактор XII — фактор Хагемана, фактор X — фактор Стюарта-Прауэра и др.) или фамилии авторов, описавших данный фактор (например, фактор Виллебранда). Для обозначения активированных факторов свертывания добавляется буква «а». Следует помнить также, что фактор VI изъят из классификации, так как представляет собой активированный фактор V. Некоторые из факторов свертывания не имеют цифровых обозначений.
Таблица 3
Факторы свертывания крови (по Р. Шмидту и Г. Гевсу в модификации)
| ФС | Название | Свойства |
| I | Фибриноген | Белок |
| II | Протромбин | α1-глобулин |
| III | Тканевой тромбопластин | Фосфолипопротеиды |
| IV | Ионы Са2* | — |
| V | Проакцелерин | β-глобулин |
| VII | Проконвертин | α-глобулин |
| VIII | Антитемофильный глобулин А (АГГ) в комплексе с фактором Вилленбранда | Β2-глобулин |
| IX | Фактор Кристмаса | α1-глобулин |
| X | Фактор Стюарта-Прауэра | α1-глобулин |
| XI | Плазменный предшественник тромбопластина (ППТ) | γ-глобулин |
| XII | Фактор Хагемана | β-глобулин |
| XIII | Фибринстабилизирующий фактор | β -глобулин |
| — | Прекалликреин (ПК) фактор Флетчера | β -глобулин |
| — | Высокомолекулярный кининоген (ВМК), фактор Фитцжеральда | α1-глобулин |
Процесс свертывания крови условно разделяют на две основные фазы:
1. Фаза активации — многоступенчатый этап свертывания, завершающийся активизацией протромбина (фактор II) с превращением его в активный фермент тромбин (фактор IIа);
2. Фаза коагуляции — конечный этап свертывания, в результате которого под влиянием тромбина фибриноген (фактор 1) превращается в фибрин.
Фаза активации
Центральным звеном сложных химических превращений этой фазы является образование так называемого «активатора протромбина», который представляет собой ферментный комплекс, состоящий из активированных факторов свертывания Ха, Va, ионов Са2+ и фосфолипопротеидов (рис. 11). Источником последних могут быть:
1. Фосфолипопротеиды, высвобождающиеся при повреждении тканей, в частности, эндотелия сосудов или соединительной ткани (тканевой тромбопластин — фактор III).
2. Фосфолипопротсиды мембран тромбоцитов, выходящие в плазму при их разрушении (тромбоцитарный фактор 3). Таким образом, формирование ключевого ферментного комплекса этой фазы — «активатора протромбина» — происходит двумя путями, в соответствии с которыми различают две системы свертывания:
1) Внешняя система, которая активируется при повреждении тканей в течение нескольких секунд. Фосфолипопротеиды, выходящие из тканевых клеток (тканевой тромбопластин, или фактор III), в присутствии ионов Са2+ активируют фактор VII (проконвертин). Последний в комплексе с фосфолипопротсидами поврежденной ткани и ионами Са2+, в свою очередь, активирует фактор X, входящий затем в состав «активатора протромбина».
2) Внутренняя система, активация которой происходит несколько медленнее (в течение минут) и без участия тканевого тромбопластина. Пусковым фактором этого механизма является фактор XII (фактор Хагемана), который активируется двумя путями:
а) при контакте крови с коллагеном субэндотелия поврежденного сосуда или с любой чужеродной поверхностью (стеклом, металлом, каолином и т. д.);
б) при ферментативном расщеплении фактора Хагемана протеолитическими ферментами (калликреином, тромбином, трипсином и др.) с участием высокомолекулярного кининогена (ВМК).
Фактор Хагемана (фактор XII) является универсальным активатором всех плазменных протеолитических систем — свертывающей, калликреин-кининовой, фибринолитической и системы комплемента.
Фактор ХIIа активирует фактор XI. Последний, в свою очередь, активирует фактор IX. Наконец, фактор IХа образует ферментный комплекс с фосфолипопротеидами, высвобождающимися при разрушении тромбоцитов (т. е. с тромбоцитарным фактором 3), который в присутствии ионов Са2+ и плазменного фактора VIIa (фактора Виллебранда) активирует фактор X. Последний также входит в состав «активатора протромбина». Образовавшийся двумя путями ключевой ферментный комплекс — «активатор протромбина» — протеолитически расщепляет неактивный предшественник протромбин (фактор II) (молекулярная масса 72 000), в результате чего образуется активный протеолитический фермент тромбин (молекулярная масса 35 000), представляющий собой пептидазу. Действие тромбина не ограничивается только протеолизом фибриногена па следующем этапе свертывания крови. Тромбин способствует также необратимой агрегации тромбоцитов (см. выше), а также активирует ряд факторов свертывания (V, VIII, XIII).
1) Из всех плазменных факторов свертывания лишь фактор VII (проконвертин) используется только во внешнем механизме свертывания.
2) Факторы XII, XI, IX, VIII и прекалликреин участвуют только во внутреннем механизме свертывания.
3) Факторы X, V, II и I используются в обеих [внутренней и внешней] системах свертывания.
Внешний и внутренний механизмы свертывания взаимосвязаны между собой: между отдельными их этапами существуют своеобразные «мостики» — альтернативные пути для процессов коагуляции. Так, комплекс факторов ХIIа-калликреин-кининоген (внутренний механизм) ускоряет активацию фактора VII (внешний механизм), а фактор Vila ускоряют активацию фактора IX (внутренний механизм).
Фаза коагуляции
В течение этой фазы происходит образование фибрина из его предшественника фибриногена (рис. 11). Процесс протекает в два этапа:
1 - фибриноген расщепляется тромбином на четыре растворимых мономера фибрина (по два пептида А и В), у каждого из которых имеются по 4 свободные связи.
2 - мономеры соединяются друг с другом, формируя полимеры, из которых строятся волок-па фибрина. Процесс необратимой полимеризации фибрина происходит с участием фибринстабилизирующего фактора XIII в присутствии ионов Са2+.
Однако па этой стадии трехмерная сеть волокон фибрина, которая содержит эритроциты, тромбоциты и другие клетки крови, все еще относительно рыхлая. Свою окончательную форму она принимает после ретракции сгустка, возникающей при активном сокращении волокон фибрина и выдавливании сыворотки. Благодаря ретракции сгусток становится более плотным и стягивает края раны.
Следует упомянуть еще об одном возможном пути превращения фибриногена в фибрин на конечной стадии свертывания крови — о так называемом феномене паракоагуляции, который наблюдается, например, при синдроме диссеминированного внутрисосудистого свертывания крови (ДВС-синдроме). В отличие от обычного (описанного выше) процесса полимеризации волокон фибрина из его мономеров, при этом синдроме значительно снижается чувствительность к. тромбину и нарушается процесс полимеризации фибрин-мономеров. Это происходит в результате того, что часть фибрин-мономеров образуют с фибриногеном и продуктами его распада комплексные крупно- и среднемолекулярные соединения — растворимые фибрин-мономерные комплексы (РФМК). Они плохо реагируют на действие тромбина, обладая относительной тромбинрезистентностью, но образуют гель при добавлении к плазме этанола, протаминсульфата или бета-нафтола. Это и есть феномен неферментативного свертывания, или феномен паракоагуляции. Выявление РФМК имеет важное значение для диагностики ДВС-синдрома (см. ниже).
|
Date: 2016-05-25; view: 1017; Нарушение авторских прав