
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Особенности окислительно-восстановительных свойств пероксида водорода
|
|
Применим сформулированные выше идеи для того, чтобы кратко проанализировать окислительно-восстановительные свойства перекиси водорода. В молекуле Н2О2 атомы кислорода связаны непрочной однократной связью, связи Н–О также одинарны, но значительно короче. Ну, а связь НО–ОН дополнительно ослаблена из-за отталкивания несвязывающих электронных пар атомов кислорода (оба атома являются потенциальными донорами, а акцепторных свойств проявить не могут из-за отсутствия вакантных орбиталей). Это объясняет низкую стабильность пероксида водорода, облегчает окислительно-восстановительные реакции с ее участием, тем более, что в атомы кислорода способны образовать гораздо более устойчивые связи (вещества). Поскольку в молекуле Н2О2 степень окисления атомов кислорода промежуточная, то для перекиси характерна окислительно-восстановительная двойственность.
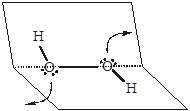

Восстановительные свойства предполагают распад двух прочных связей Н–О, после чего атомы кислорода получают возможность образовать двойную связь в молекуле О2 (О=О). При реализации окислительных свойств требуется распад слабой связи О–О, причем, если такой переход выполняется в кислой среде, то каждый атом кислорода сможет образовать дополнительную прочную связь Н–О. Поэтому для перекиси водорода окислительные свойства должны быть более характерны, особенно в кислых растворах (тем более, что под влиянием ионов Н+дополнительно ослабевают связи НО–ОН).
Подтвердить справедливость этих предположений можно как примерами конкретных реакций (см. задания лабораторного практикума по ОВР), так и численными значениями стандартных редокс -потенциалов соответствующих полуреакций:
Н2О2 + 2Н+ + 2ē → 2Н2О φ° = 1.78 В
(в кислой среде Н2О2 по окислительным свойствам не уступает перманганату калия)
Н2О2 + 2ē → 2ОН- φ° = 0.88 В
(в щелочной среде окислительные свойства Н2О2 даже выше, чем у перманганату калия в тех же условиях)
Н2О2 - 2ē → О2 + 2Н+ φ° = 0.68 В
Достаточно большое значение стандартного потенциала делает перекись термодинамически слабым восстановителем, сопоставимым с нитритами. Не случайно, что без подкисления бихромат калия не окисляет ни NO2-, ни Н2О2.
Date: 2016-01-20; view: 2030; Нарушение авторских прав