
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

И их зависимость от рН раствора
|
|
Ограничимся обсуждением ионов MnO4-и Cr2O72-, поскольку именно они чаще всего используются в качестве окислителей в водных растворах. Их восстановление до MnO2 или катионных форм (Mn2+, Cr3+) предполагает потерю центральным атомом части или всех атомов кислорода. Поэтому более сильным окислителем должен быть менее стабильный анион. Таковым, конечно, является перманганат:
 .
.
Подтвердить вывод о более сильных окислительных свойствах перманганат-иона можно большим числом примеров. В первую очередь, напомню, что теме "Катализ" описано каталитическое влияние бихромата калия на разложение пероксида водорода:
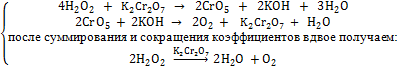
в то время как перманганат калия окисляет перекись:
3H2O2 + 2KMnO4 → 3O2 + 2MnO2 ↓ + 2КОН + 2Н2О.
Весьма показательным является отношение ионов MnO4-и Cr2O72-к обсуждавшимся в предыдущей главе сульфитам и нитритам: сульфит натрия окисляется и перманганатом, и бихроматом калия, а нитриты не взаимодействуют с K2Cr2O7 даже в кипящем растворе:
 .
.
Взаимодействие в растворе бихромата калия начинается после его подкисления. Строго обосновать влияние среды на окислительную способность иона Cr2O72-можно, конечно, на основе анализа уравнения Нернста (стр. 13, 14, табл. 3). Ну, а качественное объяснение можно дать, учитывая поляризующее влияние тех или иных катионов на энергию связей Э–О в кислородсодержащих анионах. Очень сильным поляризующим действием обладают катионы Н+. Поэтому в кислой среде уменьшается стабильность кислородсодержащих ионов (веществ), а, соответственно, значительно усиливаются их окислительные свойства:
 .
.
Убедительное подтверждение влияния среды на стабильность и окислительную активность демонстрирует поведение перманганат-иона в зависимости от рН раствора.

Схема вариантов восстановления перманганата
Как видно:
· в сильно щелочной среде ион MnO4-восстанавливается без распада связей Mn–O и может считаться окислителем средней силы (из галогенид-ионов окисляет только йодиды);
· в большом интервале рН (от среднекислых до среднещелочных растворов) ион MnO4-проявляет достаточно сильные окислительные свойства (из галогенид-ионов окисляет и йодиды, и даже бромиды), а восстанавливается с частичной потерей атомов кислорода;
· в сильнокислых растворах связи Mn–O подвергаются особенно сильному поляризующему воздействию, в итоге MnO4-восстанавливается с полной потерей атомов кислорода и выступает в роли очень сильного окислителя (окисляет очень большой круг, в том числе и слабых, восстановителей, например, даже хлорид-ионы).
Date: 2016-01-20; view: 657; Нарушение авторских прав