
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

II Окислительно-восстановительные равновесия с участием металлов
|
|
I Основные понятия
Центральным понятием данного раздела теоретической химии является " степень окисления ".[1] Степенью окисления (СО) называется формальный заряд атома, рассчитанный из предположения, что все полярные связи, образуемые им, являются ионными. Наиболее просто рассчитываются степени окисления в случае ионных веществ, состоящих из простых одноатомных ионов (KJ, Na2S, MgO, CaF2 и т.п.). В соответствие с определением в таких соединениях степени окисления совпадают с зарядами ионов: K +, J -; Na +, S 2-; Mg 2+, О 2-. Заряды атомов, связанных ковалентно (в том числе и входящих в состав сложных ионов типа SO42-, S2O32-, S2O82-…), определяются с учетом того, как "поделены" между ними валентные электроны.
А это, в свою очередь, зависит от электроотрицательностей (χ) связанных атомов. Более электроотрицательный атом заряжается отрицательно относительно атома с меньшим значением χ. Абсолютное значение СО рассчитывается с учетом валентностей атомов, числа электронов, формально перераспределенных между данным атомом и его партнерами. Скажем, самым электроотрицательным атомом является фтор (F), причем, и в ионных, и в ковалентных фторидах его степень окисления неизменна: -I, поскольку электронное строение атома позволяет ему реально или формально завладеть лишь одним дополнительным электроном.[2] Такую же степень окисления имеют и другие галогены в большинстве своих соединений
(в ионных и ковалентных галогенидах). Но при связывании с атомом фтора они, естественно, заряжаются положительно (например, Cl +III F3, J +VII F7). Однако более важными примерами такого рода являются кислородные соединения галогенов. Поскольку кислород уступает по электроотрицательности только фтору, то во всех соединениях, кроме O +II F2, O +I 2F2, а также простого вещества (О2) и озона (О3)1 атомы кислорода приобретают отрицательные степени окисления. Причем, если оба его неспаренных электрона оказываются задействованы в связывании с менее электроотрицательными атомами (что бывает чаще всего), то такой атом кислорода формально "завладевает" двумя дополнительными электронами от соответствующих атомов-партнеров (они в большей степени будут принадлежать атому кислорода, больше времени проводить на его атомных орбиталях). В таких соединениях степень окисления атома кислорода оказывается равной -II (например, оксиды, оксокислоты и их соли, органические кислородные соединения – спирты, альдегиды, карбоновые кислоты и т.п.). Но, если один из неспаренных электронов используется для образования неполярной связи О–О, то заряд атома кислорода определяется полярностью другой связи. Например, в упоминавшемся ранее фториде O2F2 атом кислорода оказывается положительным, но более распространенными соединениями, содержащими двухатомную цепочку О–О являются пероксиды (ионные, типа BaO2, Na2O2 или ковалентные, типа Н2О2). В них степень окисления атома кислорода составляет -I.
Рассмотрим еще несколько примеров кислородсодержащих кислот серы, чтобы убедиться, что правильный расчет степеней окисления возможен только при учете реального строения вещества. В кислотах H2SO4, H2S2O3, H2S2O7 и H2S2O8 атомы водорода уступают по электроотрицательности и атомам кислорода, и атомам серы: χН = 2.1, χS = 2.44, χО = 3.5. Поэтому в данных кислотах СО (Н) = +I независимо от того с атомами каких элементов они окажутся связанными. Тем не менее, отметим, что большинство кислородсодержащих кислот и, в частности рассматриваемые, являются гидроксидами, т.е. в их составе атомы водорода связаны с атомами кислорода. Менее очевидна ситуация со степенями окисления атомов серы и кислорода: если в молекуле присутствуют связи О–О, то эти атомы будут иметь СО = -I (за счет полярных связей О–Н или О–S), при наличии связей S–S соответствующие атомы окажутся не столь положительными, чем, если бы этих связей не было. Для начала предположим, что пероксидных атомов кислорода в молекулах нет, т.е. СО (О) = -II. Рассчитаем степень окисления атомов серы. В составе молекулы серной кислоты СО (S) = 6, что соответствует высшему возможному значению: сера – элемент VI-ой группы главной подгруппы, следовательно, в атоме серы шесть валентных электронов. И в данном случае они формально все "теряются в пользу" более электроотрицательных атомов кислорода. При анализе других молекулах опять же для простоты предположим вначале, что оба атома серы в их составе равноценны и имеют одинаковые степени окисления.
| Результаты расчета степеней окисления атомов серы на основе предположений, выполненных в тексте | |||
| H2SO4 СО(S) = 8 - 2 = VI | H2S2O3 СО(S) = ½·(6 - 2) = II | H2S2O7 СО(S) = ½·(14 - 2) = VI | H2S2O8 СО(S) = ½·(16 - 2) = VII |
Последний результат совершенно абсурден, поскольку он превышает максимально возможное значение. Причем причиной ошибки не может быть усреднение зарядов атомов серы (предположение их равноценности). Не менее абсурдным было бы полагать, что суммарный заряд двух атомов серы +14 можно распределить как +6 и +8. Явно, что слишком большой отрицательный заряд приписан атомам кислорода. Видимо, некоторые из них являются пероксидными.
Второй результат тоже, как минимум, сомнителен, поскольку в степени окисления +II для серы надежно известен только хлорид SCl2. Если предположить в молекуле H2S2O3 наличие пероксидных атомов кислорода, то уменьшится средний заряд атомов кислорода, а, следовательно, и атомов серы. Скорее нужно полагать, что в данном случае атомы серы неравноценны, имеют разные степени окисления.
Сравним эти рассуждения с реальным строением молекул кислот.
| Результаты расчета степеней окисления атомов серы на основе реального строения молекул кислот | |||
H2SO4
Серная кислота
 Атом серы образует шесть связей с более электроотрицательными атомами кислорода, соответственно,
СО(S) = +VI
Атом серы образует шесть связей с более электроотрицательными атомами кислорода, соответственно,
СО(S) = +VI
| H2S2O3
Тиосерная кислота
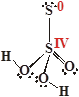 Центральный атом серы образует четыре связи с атомами кислорода, а "концевой" образует, на первый взгляд, неполярные связи S–S:
СО(S) = 4, СО(S) = 0
Центральный атом серы образует четыре связи с атомами кислорода, а "концевой" образует, на первый взгляд, неполярные связи S–S:
СО(S) = 4, СО(S) = 0
| H2S2O7
Дисерная кислота
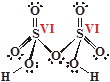 Оба атома серы образуют по шесть связей с атомами кислорода, соответственно, СО(S) = +VI
Оба атома серы образуют по шесть связей с атомами кислорода, соответственно, СО(S) = +VI
| H2S2O8
Пероксо-дисерная кислота
 Оба атома серы образуют по шесть связей с атомами кислорода, соответственно, СО(S) = +VI,
В то же время в молекуле имеются два пероксидных атома кислорода.
Оба атома серы образуют по шесть связей с атомами кислорода, соответственно, СО(S) = +VI,
В то же время в молекуле имеются два пероксидных атома кислорода.
|
Окислительно-восстановительными называются реакции, в ходе которых происходит перераспределение электронов между структурными единицами взаимодействующих веществ (атомами, молекулами, ионами), за счет чего меняются заряды (степени окисления) отдельных атомов. Такие процессы можно формально, а в ряде случаев и реально, разбить на два этапа (стадии), две полуреакции. Этап, в ходе которого реагирующие частицы присоединяют электроны (атомы какого-то элемента понижают степень окисления) называется процессом восстановления. Сама частица (атом, ион, молекула) является окислителем. Полуреакция, в ходе которой происходит потеря электронов и повышение степени окисления того или иного атома (атомов) называют процессом окисления. Сама частица проявляет свойства восстановителя.[3]
II Окислительно-восстановительные равновесия с участием металлов
Наиболее просто выглядят уравнения окислительно-восстановительных процессов с участием металлов и их одноатомных ионов. В разнообразных формах они могут протекать как на поверхности, так и в объеме металлов.
Date: 2016-01-20; view: 729; Нарушение авторских прав