
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Понятие об идеальном газе,Законы и уравнения состояния идеального газа
|
|
Основные представления и методы в молекулярно-кинетической теории вещ-ва
Молекулярная физика и термодинамика-разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в телах атомов и молекул. Для исследования этих процессов применяют два качественно различных и взаимно дополняющих друг друга метода: статистический (молекулярно-кинетический) и термодинамический. Первый лежит в основе молекулярной физики, второй — термодинамики. Молекулярная физика- раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.Процессы, изучаемые молекулярной физикой, являются результатом совокупного действия огромного числа молекул.Законы поведения огромного числа молекул, являясь статистическими закономерностями, изучаются с помощью статистического метода. Этот метод основан на том,что свойства макроскопической системы в конечном счете определяются свойствами частиц системы. Например, температура тела определяется скоростью хаотического движения его молекул, но так как в любой момент времени разные молекулы имеют различные скорости, то она может быть выражена только через среднее значение скорости движения молекул. Нельзя говорить о температуре одной молекулы. Таким образом, макроскопические характеристики тел имеют физический смысл лишь в случае большого числа молекул.
Понятие об идеальном газе,Законы и уравнения состояния идеального газа
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой считают, что:1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;2) между молекулами газа отсутствуют силы взаимодействия;3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным (например, кислород и гелий), а также при низких давления» и высоких температурах близки по своим свойствам к идеальному газу. Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона-Менделеева)-формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: 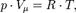 где P-давление,
где P-давление, 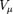 -молярный объём,T-абсолютная температура,R-универсальная газовая постоянная.
-молярный объём,T-абсолютная температура,R-универсальная газовая постоянная. 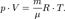 Эта форма записи носит имя уравнения (закона) Менделеева - Клапейрона.
Эта форма записи носит имя уравнения (закона) Менделеева - Клапейрона. 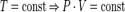 - закон Бойля-Мариотта.
- закон Бойля-Мариотта. 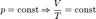 - закон Гей-Люссака.
- закон Гей-Люссака. 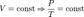 - закон Шарля (второй закон Гей-Люссака)Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана:
- закон Шарля (второй закон Гей-Люссака)Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана: 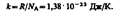 След-но
След-но 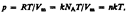 где N A /V m = n — концентрация молекул (число молекул в единице объема).
где N A /V m = n — концентрация молекул (число молекул в единице объема).
1.3Внутренняя энергия,работа и теплота в термодинамике.Теплоёмкость вещ-ва.Работа расширения газа
Внутренняя энергия — однозначная функция термодинамического состояния системы, т. е. в каждом состоянии система обладает вполне определенной внутренней энергией. Допустим, что некоторая система (газ, заключенный в цилиндр под поршнем), обладая внутренней энергией U 1, получила некоторое количество теплоты Q и, перейдя в новое состояние, характеризующееся внутренней энергией U 2, совершила работу А над внешней средой, т. е. против внешних сил. Количество теплоты считается положительным, когда оно подводится к системе, а работа — положительной, когда система совершает ее против внешних сил. Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии D U=U 2– U 1 будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой А, совершенной системой против внешних сил: 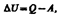 или
или 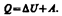 (1)Уравнение (.1) выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. (1) в дифференциальной форме будет иметь вид
(1)Уравнение (.1) выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. (1) в дифференциальной форме будет иметь вид 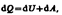 или в более корректной форме
или в более корректной форме 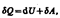 где dU — бесконечно малое изменение внутренней энергии системы, dA — элементарная работа, dQ — бесконечно малое количество теплоты. В этом выражении dU является полным дифференциалом, а dA и dQ таковыми не являются. ля рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде. Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние d l, то производит над ним работу
где dU — бесконечно малое изменение внутренней энергии системы, dA — элементарная работа, dQ — бесконечно малое количество теплоты. В этом выражении dU является полным дифференциалом, а dA и dQ таковыми не являются. ля рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде. Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние d l, то производит над ним работу 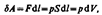 где S- площадь поршня, S d l=dV- изменение объема системы. Таким образом,
где S- площадь поршня, S d l=dV- изменение объема системы. Таким образом, 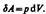 Полная работа
Полная работа 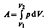 Удельная теплоемкость вещества- величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
Удельная теплоемкость вещества- величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К: 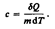 Молярная теплоемкость- величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
Молярная теплоемкость- величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К: 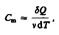
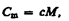 выражение первого начала термодинамики для 1 моль газа:
выражение первого начала термодинамики для 1 моль газа: 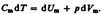
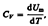 .
. 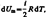 тогда
тогда 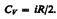
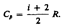 Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы.
Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы.
Date: 2015-05-09; view: 931; Нарушение авторских прав