
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Второе начало термодинамики. Условие эволюции для изолированной системы
|
|
Второе начало термодинамики имеет несколько эквивалентных формулировок и две части. Мы используем первую часть так. В дифференциальной форме первого начала термодинамики
d q = d u + p d v + ∑ Aj d aj - ∑m k d Nk, (1)
изменение d q в квазиравновесной системе всегда можно представить через полный дифференциал однозначной функции термодинамического состояния, называемой энтропией, согласно формуле (формулировка Клаузиуса)
d q = T d s,
т.е. 1/ T является интегрирующим множителем для (1). В общем случае при наличии необратимых процессов внутри системы d s = d sext + d sin. Индексы ext и in в соответствии с физическим смыслом обозначают внешний и внутренний. Здесь d sext – изменение энтропии системы, обусловленное обменом энергией и веществом с ОС, а d sin – изменение энтропии, обусловленное необратимостью процессов внутри системы. Для закрытой системы, которая не обменивается веществом с внешней средой, d sext = d q / T. Величина d sext может быть положительной и отрицательной, а d sin – только большей или равной нулю. В изолированной системе d sext = 0.
Вторая часть II начала термодинамики утверждает, что в изолированной системе (d sext = 0) могут происходить только процессы, сопровождаемые ростом энтропии, т.е. s = d sin /d t = d s /d t > 0 (d t > 0). Функцию s называют производством энтропии. Отсюда следует, что для всякого неквазистатического процесса, протекающего в ТС T d S > d Q где d Q - количество тепла, поглощенного системой при неравновесном (неквазистатическом) переходе из 1-го состояния во 2-е, такое, что d S = S 2 - S 1. Отметим, что все другие экстенсивные параметры (кроме энтропии) в изолированной системе сохраняются (остаются неизменными).
Рис. 5. отстствует блин
В состоянии равновесия энтропия изолированной системы достигает максимума. При этом термодинамическое равновесие соответствует наибольшей степени неупорядоченности системы. Данное обстоятельство обосновывается в статистической физике при определении энтропии в терминах теории вероятности. В то же время неотрицательная функция s, имеющая нуль в равновесной точке должна иметь в этой точке минимум. Поэтому имеем d s £ 0. Данное неравенство называют условием эволюции. Знак равенства относится к равновесному состоянию. Таким образом, изолированная система эволюционирует до тех пор, пока производство энтропии не станет равным нулю.
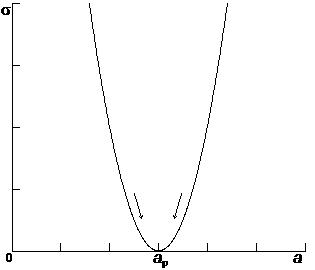
Рис. 6.
Экстремальные свойства функций S и s при отмеченных условиях приводят к определенным неравенствам для физических величин, обычно называемых условиями устойчивости. В частности, опираясь на это, выводятся неравенства Cv > 0 и (¶p/¶ v) T < 0.
Более того, идет ли речь об изолированных, закрытых или открытых системах, всегда выполняется неравенство d Sin ³ 0. Это и есть самая общая формулировка второго начала термодинамики. Важно, что она применима не только ко всей системе, но и ко всем подсистемам. Например, если разделить систему на две части (подсистемы) то выполняется не только неравенство
d Sin = d Sin1 + d Sin2 ³ 0
где d Sin1, d Sin2 - энтропии, произведенные в каждой подсистеме, но и неравенства
d Sin1 ³ 0, d Sin2 ³ 0.
Однако никогда не может быть такого, чтобы
d Sin1 ³ 0, d Sin2 < 0 и d Sin = d Sin1 + d Sin2 ³ 0.
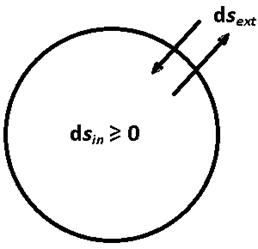
Рис. 7.
Аналогичные формулировки 2-го начала термодинамики возможны и для не изолированных систем. Если, например, в системе с постоянным числом частиц (N = const) поддерживается постоянная температура (изотермический случай T = const) и не совершается работа d l = 0 (d v = 0), то вместо D S ³ 0, будет выполняться неравенство D F £ 0, где F = U - TS — свободная энергия. Знак (=) относится к обратимым процессам, (<) - к необратимым.
18. Причины необратимости реальных термодинамических процессов. Влияние трения на процесс истечения.
Date: 2015-05-09; view: 763; Нарушение авторских прав