
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Реальные вещества
|
|
Реальные вещества могут существовать в трех агрегатных состояниях: твердом, жидком и газообразном. На диаграммах состояния между этими агрегатными вариантами существуют линии раздела, а точка их пересечения, при которой вещество находится одновременно в трех агрегатных состояниях называется тройной точкой. Проекция диаграммы состояния однокомпонентной системы на плоскость p, T представлена на рисунке 3.
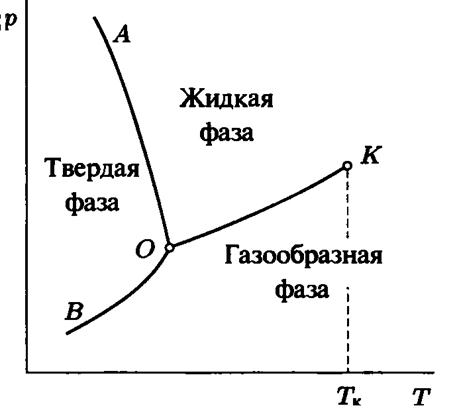
Рис. 3.
Для воды p 0 = 610.8 Па, t 0 = 0.01 ° C, для жидкой фазы v = 0.0010002 м /кг.
Для технических приложений термодинамики важно изменение внутренней энергии U в процессах, т.е. начало отсчета U может быть выбрано произвольно (для чистых веществ и их смесей без химических реакций). В связи с этим условились за начало отсчета внутренней энергии принять ее значение в тройной точке воды. Поскольку h = u + pv, то в тройной точке значение h в жидком состоянии равно 0.611 Дж/кг в соответствии с приведенными параметрами в этой точке.
Переходы через линии фазового равновесия ОА, ОВ, ОК называются: ТП – возгонка, ПТ – сублимация; ТЖ – плавление, ЖТ – затвердевание; ЖП – испарение, ПЖ – конденсация. ОК – линия насыщения, ее уравнение p = p (T); К – критическая точка. В ней нет различия между жидкостью и газом, в частности коэффициент поверхностного натяжения равен нулю. Для воды pk = 22.115 МПа, t к = 374.12 ° C; для азота p к = 3.39 МПа, t к = –146 ° C.
Отмеченные фазовые переходы сопровождаются поглощением (выделением) тепловой энергии. Кроме переходов ЖП через линию ОК на рис. 3 возможен и обходной путь L. В этом случае переход осуществляется непрерывно без скачков и резкого изменения плотности, а также без резкого выделения или поглощения скрытого тепла (в общем случае Q скр. ¹ Q непр., поскольку d q – не полный дифференциал). Возможность непрерывного перехода из жидкого состояния в газообразное (и обратно) показывает всю условность терминов «жидкость» и «газ». Строго говоря, пользоваться терминами «жидкость» и «газ» можно только тогда, когда они существуют одновременно, и соприкасаются друг с другом по некоторой поверхности раздела, то есть являются фазами. Линии раздела фаз являются образами при проектировании на плоскость P, T двумерной области, т.е. представляют собой особые множества при отображении.
Отметим, что критическая точка существует только при сосуществовании жидкой и газообразной фаз. Это связано с тем, что свойства данных фаз изотропны (не зависят от направления в пространстве). Различия – в силах молекулярного взаимодействия. Переходы между различными модификациями твердого тела (например, графит-алмаз, фазы льда, а также ТЖ, ТП) непрерывным образом происходить не могут, поскольку данные модификации имеют различную симметрию расположения молекул, которая не может непрерывно изменяться. Симметрия меняется скачком. В этом случае всегда существуют линии фазового перехода, которые либо уходят в бесконечность, либо заканчиваются на другой линии фазового перехода.
Если смотреть сверху на рис. 3 вдоль оси v, то линия перехода ПЖ можно представить из 3-х участков. Первый - до линии ОК, далее вертикальный подъем (на рис. 3 незаметный) вдоль оси v. При этом в системе возникает (в соответствующих координате v долях) паровая фаза (+ жидкая фаза), т.е имеем двухфазную систему. Далее от линии ОК движемся имея в ТС только жидкую фазу. Если двигаться обходным путем (огибая точку К), то имеем «пологий» подъем. При этом параметры системы меняются непрерывно.
7. Термодинамические процессы в закрытых системах.
Date: 2015-05-09; view: 863; Нарушение авторских прав