
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Первое начало термодинамики для простых тел
|
|
Для простых тел, то есть систем, состояние которых определяется двумя независимыми переменными, термодинамическая работа определяется как 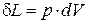 и математическое выражение первого начала термодинамики в дифференциальной форме примет следующий вид:
и математическое выражение первого начала термодинамики в дифференциальной форме примет следующий вид:
для термодинамической системы
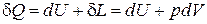 ; (42)
; (42)
для 1 кг системы
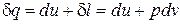 . (43)
. (43)
Выражение удельной потенциальной работы можно представить в виде соотношения
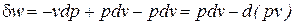 , (44)
, (44)
из которого следует, что
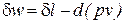 ;
;  . (45)
. (45)
После подстановки выражения 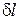 (45) в уравнение (43), получим:
(45) в уравнение (43), получим:
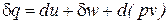 ,
, 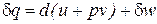 . (46)
. (46)
Сумма удельной внутренней энергии ( ) и потенциальной
) и потенциальной
функции (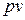 ) называется удельной энтальпией (
) называется удельной энтальпией (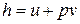 ) (Дж/кг).
) (Дж/кг).
Поскольку энтальпия определяется с помощью параметров состояния (u, р, v), то она является функцией состояния, а для простого тела может быть представлена в функции любых двух параметров, например, р и Т. Дифференциал функции состояния является полным дифференциалом и, следовательно,
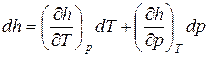 . (47)
. (47)
Подобно полной внутренней энергии энтальпия системы является экстенсивным параметром, зависит от количества вещества и определяется по соотношению 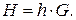
Первое начало термодинамики для 1 кг простого тела по балансу рабочего тела в дифференциальной и интегральной форме можно представить в следующем виде:
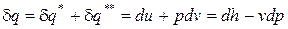 ; (48)
; (48)
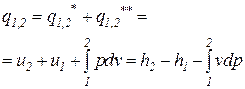 . (49)
. (49)
Математическое выражение первого начала термодинамики по внешнему балансу в дифференциальной и интегральной форме имеет следующий вид:
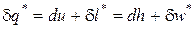 ; (50)
; (50)
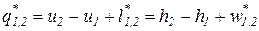 . (51)
. (51)
В реальных процессах эффективная потенциальная (техническая) работа 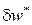 равна разности обратимой работы
равна разности обратимой работы 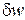 и работы необратимых потерь
и работы необратимых потерь 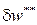 , которая превращаются в теплоту внутреннего теплообмена
, которая превращаются в теплоту внутреннего теплообмена 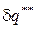
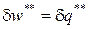 . (52)
. (52)
В обратимых процессах 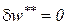 и поэтому выражение первого начала термодинамики по внешнему балансу совпадает с выражением первого начала термодинамики по балансу рабочего тела.
и поэтому выражение первого начала термодинамики по внешнему балансу совпадает с выражением первого начала термодинамики по балансу рабочего тела.
Date: 2015-05-09; view: 1688; Нарушение авторских прав