
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Идеальные газы
|
|
Идеальными называются газы, у которых молекулы представляют собой материальные точки и между молекулами отсутствуют силы взаимодействия.
При относительно низком давлении и высоких температурах реальные газы имеют малую плотность и, с известным допущением, могут рассматриваться как газы идеальные.
Законы идеальных газов были установлены в XVII - XIX столетиях исследователями, изучавшими экспериментальным путем поведение газов при давлениях, близких к атмосферному.
Закон Бойля (1662 г.) – Мариотта (1676 г.): произведение абсолютного давления на удельный объем идеального газа при неизменной температуре есть величина постоянная, т.е. произведение абсолютного давления на удельный объем идеального газа зависит только от температуры газа:
при t = idem рv= idem. (24)
Закон Гей Люссака ( 1802 г. ) – относительное расширение идеальных газов при неизменном давлении (p=idem) пропорционально повышению температуры
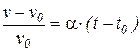 , (25)
, (25)
при 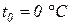
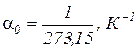 ;
; 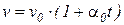 , (26)
, (26)
где v – удельный объем газа при температуре t и давлении p; v0 – удельный объем газа при температуре t 0 = 0 0C; 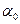 – температурный коэффициент объемного расширения идеальных газов при t0 = 0 0C, сохраняющий одно и то же значение при всех давлениях и одинаковый для всех идеальных газов.
– температурный коэффициент объемного расширения идеальных газов при t0 = 0 0C, сохраняющий одно и то же значение при всех давлениях и одинаковый для всех идеальных газов.
Из сопоставления этих законов выводится уравнение состояния идеальных газов - уравнение Клапейрона (1834 г.):
для 1 кг газа 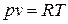 ; (27)
; (27)
для 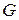 кг газа
кг газа  , (28)
, (28)
где 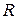 – характеристическая постоянная газа; Т – абсолютная температура газа
– характеристическая постоянная газа; Т – абсолютная температура газа
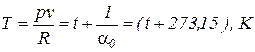 . (29)
. (29)
Продифференцировав уравнение Клапейрона при постоянном давлении, получим: 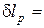
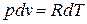 .
.
Отсюда
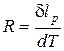 . (30)
. (30)
Это значит, что характеристическая газовая постоянная (R) – это термодинамическая работа 1 кг газа в изобарном процессе (p = idem) при изменении температуры газа на один градус.
Закон Авогадро ( 1811 г. ) – объем одного киломоля идеального газа не зависит от его природы и вполне определяется параметрами состояния газа 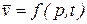 .
.
Молярный объем идеального газа с использованием уравнения Клапейрона определяется из соотношения
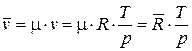 , (31)
, (31)
где 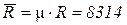 Дж/(кмоль×К) – универсальная газовая постоянная.
Дж/(кмоль×К) – универсальная газовая постоянная.
Уравнения состояния для 1 кмоля и для  кмолей идеального газа имеют следующий вид:
кмолей идеального газа имеют следующий вид:
для 1 кмоля газа 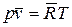 ; (32)
; (32)
для 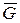 кмолей газа
кмолей газа 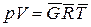 . (32а)
. (32а)
Эти уравнения называются уравнениями Клапейрона – Менделеева.
Закон Джоуля определяет, что внутренняя энергия идеального газа зависит только от температуры
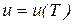 ;
; 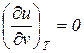 . (33)
. (33)
Date: 2015-05-09; view: 764; Нарушение авторских прав