
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Реальный газ
|
|
Газ, свойства которого (в отличие от идеального газа) зависят от взаимодействия молекул, называется реальным. Реальные газы хорошо описываются моделью классического идеального газа, если они достаточно разреженные (давления малые) и имеют высокую температуру.
Молекулы реального газа имеют собственный объем, за счет чего фактический свободный объем, в котором могут двигаться молекулы, равен V - b, где b - объем, который занимают собственно молекулы. Кроме того, действие сил притяжения вызывает увеличение давления на величину p¢ = а/V 2, где a - константа. Таким образом, уравнение состояния реального газа (уравнение Ван дер Ваальса) для одного моля имеет вид:
(р + р¢)(V - b) = RT. (7.29)
Типичные значения констант а и b для некоторых газов приведены в табл. 7.1.
Табл. 7.1 –Константы Ван дер Ваальса для некоторых газов
| Газ | а ×10-1, м4×Н/моль | b ×10-3, м3/моль |
| Кислород О2 | 1,36 | 0,0318 |
| Двуокись углерода СО2 | 3,59 | 0,0427 |
| Хлор Сl2 | 6,51 | 0,0562 |
| Гелий Не | 0,034 | 0,0237 |
| Водород Н2 | 0,244 | 0,0266 |
| Метан СН4 | 2,25 | 0,0428 |
| Азот N2 | 1,39 | 0,0391 |
Примечание: 1 м4×Н/моль = 1 Дж×м3/моль2 =10 л×бар/моль2; 1 м3/моль = 103 л/моль
| Иоганн Ван дер ВААЛЬС (1837-1923) Голландский ученый, известный как автор уравнения состояния реальных газов и жидкостей. За эти исследования получил Нобелевскую премию 1910 года. Был первым, кто понял необходимость учета объема молекул и межмолекулярных сил во время установления соотношений между давлением, объемом и температурой газов и жидкостей. | 
|
Изотермы реального газа приведены на рис. 7.6. В случае высоких температур изотерма реального газа не отличается от изотермы идеального газа. При определенной температуре Ткр (критическая температура) на изотерме наблюдается перегиб. Под пунктирной линией расположена область двухфазных состояний Ж+П (жидкость и насыщенный пар), слева от нее находится область жидкого состояния Ж, а справа – область пара П. Пар отличается от других газообразных состояний Г тем, что во время изотермического сжатия претерпевает процесс сжижения. Газ Г при температуре, большей критической, не может быть преобразован в жидкость.
Изохорный переход из точки А в точку В и далее изобарный переход из точки В в точку С дают возможность получить жидкость из газа. На этом основан принцип сжижения газов.
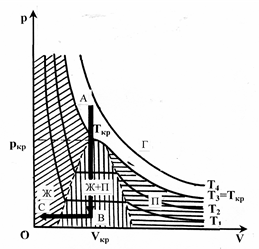
| Рис. 7.6. Изотермы реального газа (пояснения в тексте) |
Пример
Один моль двуокиси углерода при температуре 293 К занимает объем 2 л. Определить давление, создаваемое газом, при помощи уравнений состояния идеального и реального газов.
Date: 2015-05-09; view: 829; Нарушение авторских прав