
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Решение. Используем виртуальные психрометрические таблицы, в которых задаются температуры сухого (Tdry) и смоченного (Twet) термометров
|
|
Используем виртуальные психрометрические таблицы, в которых задаются температуры сухого (Tdry) и смоченного (Twet) термометров, атмосферное давление в миллибарах (напоминаем, что 760 мм рт.ст. = 1 атм = 1,013×105 Па = 1,013×103 гПа = 1,013×103 мбар), а также психрометрический коэффициент А. Если использовать в психрометрическом уравнении (7.34) единицы упругости и атмосферного давления в миллибарах (гектопаскалях), то это уравнение примет вид:
е = Е1(гПа) – А(tС – tЗМ)рА(гПа) = Е1(гПа) – 6,62×10-4 (tС – tЗМ) 1,013×1 03 (гПа)=
=Е1(гПа) – 6,7×10-1 (гПа)(tС – tЗМ).
Таким образом, в виртуальную психрометрическую таблицу подставляем значение психрометрического коэффициента при атмосферном давлении А = 0,67, а также температуры сухого и смоченного термометров: Tdry = 30 0С, Twet = 19 0С. Нажимаем на кнопку “Enter” и получаем: упругость водного пара (“vapor pressure”) е = 14,590 гПа, упругость насыщенного пара (“saturation vapor pressure”) Е = 42,456 гПа, абсолютную влажность (“absolute humidity”) а = 10,4 г×м-3, относительную влажность (“relative humidity”) r = 34,4 %, массовую долю влажности (“specific humidity”) q = 9,0×10-3 г×г-1, точку росы (“dew point”) Тd = 12,6 0С.
Контрольное задание
Используя виртуальные психрометрические таблицы, определить упругость водного пара е, упругость насыщенного пара Е, абсолютную влажность а, относительную влажность воздуха r, массовую долю влажности q и точку росы Тd. Температуры сухого и смоченного термометров определяются по таблицам из предыдущего контрольного задания в соответствии с вариантом, устанавливаемым преподавателем. Атмосферное давление равно 760 мм рт. ст.
ОСМОС
Рассмотрим диффузию вещества через полупроницаемую мембрану, которая разделяет раствор и чистый растворитель; такая мембрана в состоянии пропускать молекулы растворителя, но не пропускает молекулы растворенного вещества. Осмос – это проникновение чистого растворителя через полупроницаемую мембрану в раствор. Для водных растворов осмос означает переход воды из участка с высокой концентрацией воды в участок с низкой концентрацией воды. Полупроницаемая мембрана - это тонкий слой материала, способный пропускать определенные вещества через себя и задерживать другие. В качестве примера можно привести возможность полупроницаемых мембран пропускать малые молекулы кислорода, воды, двуокиси углерода, глюкозы, аминокислот, тогда как большие молекулы сахаров, крахмала и белков не проходят через эти мембраны.
Перенос молекул растворителя обусловлен осмотическим давлением. Выравнивание концентраций по обе стороны мембраны, которая пропускает малые молекулы растворителя, но задерживает большие молекулы растворенного вещества, возможно лишь при односторонней диффузии растворителя. Именно поэтому осмос всегда осуществляется в направлении от чистого растворителя к раствору (или от разбавленного раствора к концентрированному).
Если погрузить раствор, отделенный от внешнего пространства мембраной, в чистый растворитель (рис. 7.10) при одинаковом гидростатическом давлении,
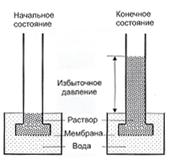
| Рис. 7.10. Суммарная диффузия растворителя в раствор через полупроницаемую мембрану |
произойдет суммарная диффузия растворителя в раствор. Диффузия закончится, когда будет достигнуто определенное, осмотическое давление в растворе. Осмотическое давление можно измерить – оно равно тому избыточному давлению, которое необходимо приложить со стороны раствора, чтобы остановить осмос. Биологические вещества представляют собой слабые водные растворы, в которых вода занимает до 95% объема; таким образом, осмотические потоки через биологические мембраны обусловливают водные потоки из участков высокой концентрации воды (слабые растворы) в участки низкой концентрации воды (более концентрированные растворы). В вакуолях растительных клеток содержатся растворы солей, сахаров, органические кислоты и аминокислоты. Вследствие этого клетки постоянно осмотически поглощают воду и образуют внутреннее гидростатическое давление, называемое тургорным. Это давление направлено на клеточную оболочку и делает ее упругой. Одновременно клеточная оболочка противодействует осмотическому давлению; это действие клеточной оболочки на цитоплазму характеризуется осмотическим потенциалом. Когда устанавливается динамическое равновесие, поступление воды в клетку прекращается. Осмотическая концентрация вакуолярного сока в клетках надземной части растения более высокая, чем в клетках корня; именно благодаря этому вертикальному градиенту осмотической концентрации сок достигает верхушки растения. Таким образом, осмотическое давление в растительном организме – один из важнейших факторов, влияющих на распределение воды и питательных веществ.
В разбавленных растворах растворенное вещество напоминает идеальный газ, поэтому к этому веществу можно применить законы идеального газа. Зависимость осмотического давления от концентрации растворенного вещества совпадает по форме с уравнением Клапейрона-Менделеева:
росмV = 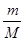 RT, (7.36)
RT, (7.36)
где росм – осмотическое давление; Т – абсолютная температура; 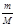 = n - количество молей растворенного вещества в объеме V; m – масса растворенного вещества; М - молярная масса растворенного вещества; R = 8,314 Дж×моль-1×К-1 - универсальная газовая постоянная.
= n - количество молей растворенного вещества в объеме V; m – масса растворенного вещества; М - молярная масса растворенного вещества; R = 8,314 Дж×моль-1×К-1 - универсальная газовая постоянная.
Если ввести в формулу (7.36) концентрацию раствора, то можно получить уравнение Вант-Гоффа:
росм = CART, (7.37)
где СА = n / V – молярная концентрация растворенного вещества.
Пример
Определить осмотическое давление, если молярная концентрация растворенного вещества равна 450 моль×м-3 при температуре 300 К.
Date: 2015-05-09; view: 988; Нарушение авторских прав