
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Средняя энергия теплового движения молекул равна кинетической энергии
|
|
молекулы, движущейся со средней квадратичной скоростью.
В действительности молекулы могут иметь не дискретные, а непрерывные значения скоростей. Следовательно, в реальности число групп k молекул, имеющих разные скорости, бесконечно велико k ®¥. В этом случае относительные доли числа молекул N1/N, N2/N, …, имеющих соответствующие скорости, следует заменить аналогичной величиной dF(u):
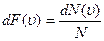 ,
,
которая равна числу молекул, имеющих величину модуля скорости большую u -d u, и меньшую u + du, деленную на полное число частиц. Понятно, что чем больше величина du, тем больше dF (u): dF (u)= f (u) du, где f (u) - функция, характеризующая распределение молекул по величине скорости.
С учетом сказанного формула (1.14) в этом случае может быть переписана в виде (сумма преобразуется в интеграл):
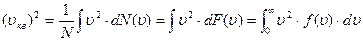 , (1.15)
, (1.15)
причем интегрирование проводится по всем возможным значениям модуля скорости.
В случае идеального газа, находящегося в тепловом равновесии, функция f (u) была получена Дж.. Максвеллом и имеет вид:
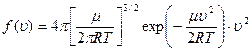 ,
,
где m - молярная масса газа, а T - равновесная температура. Таким образом, величина (uкв)2 для одноатомного идеального газа определится значением интеграла[2]
 .
.
Таким образом, средняя квадратичная скорость молекул одноатомного газа равна:
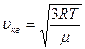 .
.
Далее мы получим этот результат элементарными методами, что показывает справедливость упрощенного подхода, примененного при выводе основного уравнения молекулярно-кинетической теории.
Сопоставление с уравнением Клайперона - Менделеева. Воспользовавшись тем, что концентрация молекул n=N/V, основное уравнение молекулярно-кинетической теории можно записать в виде:
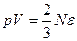 .
.
Сравнивая это выражение с уравнением состояния идеального газа (1.11),
приходим к выводу, что:
 .
.
С другой стороны, число молекул газа можно выразить через число молей и число Авогадро: N=nNа= 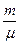 Nа. Поэтому для средней кинетической энергии молекул получим формулу:
Nа. Поэтому для средней кинетической энергии молекул получим формулу:
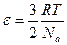 . (1.16)
. (1.16)
Напомним, что согласно формуле (1.8), универсальная газовая постоянная R относится к одному молю газа, содержащему N а молекул. Из последнего выражения видно, что удобно ввести новую постоянную k, представляющую собой универсальную газовую постоянную в расчете на одну молекулу:
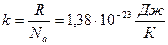 (1.17)
(1.17)
Фундаментальная постоянная k называется постоянной Больцмана.
Теперь формулу (1.16) можно записать в виде:
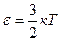 . (1.18)
. (1.18)
Интересно, что средняя кинетическая энергия молекул газа определяется только температурой газа. Следовательно, если два газа имеют молекулы разной массы, то среднеквадратичная скорость больше у газа с более легкими молекулами.
В заключение данного пункта приведем альтернативную форму уравнения состояния идеального газа, которую можно получить, если в уравнении (1.11) заменить универсальную газовую постоянную, воспользовавшись выражением (1.17):
 р=nkT. (1.19)
р=nkT. (1.19)
Такое же соотношение получится, если подставить величину e из формулы (1.18) в основное уравнение молекулярно-кинетической теории.
Date: 2015-05-09; view: 849; Нарушение авторских прав