
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Закон равнораспределения энергии по степеням свободы. Внутренняя энергия идеального газа
|
|
Как было показано ранее, средняя кинетическая энергия e поступательного движения молекулы идеального газа может быть выражена через среднюю квадратичную скорость u:
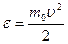 .
.
С другой стороны, квадрат любого вектора можно представить как сумму квадратов его координат:
u2=u2x+u2y+u2z.
Беспорядочность движения по всем направлениям означает, что должно быть: u2x=u2y=u 2z . Следовательно,
u2x=u2y=u2z=u2/3
С другой стороны, величины m0u2x/2, m0u2y/2, m0u2z/2 представляют собой энергию поступательного движения вдоль каждой из трех осей координат или энергию, приходящуюся на одну степень свободы.
Числом степеней свободы называется число независимых координат, которые необходимо задать для определения положения тела в пространстве. Положение материальной точки в пространстве определяется тремя координатами - 3 степени свободы. Для того, чтобы задать положение гантельки (т.е. тела, состоящего из двух жестко связанных материальных точек), необходимо задать положение ее центра масс (три координаты) и еще два угла, которые составляет ось гантельки с двумя из осей координат (угол с третьей осью координат не является независимым) - 5 степеней свободы. В общем случае несимметричное твердое тело имеет 6 степеней свободы.
В случае поступательного движения молекул газа, как мы уяснили, на каждую степень свободы приходится 1/3 общей энергии молекулы, т.е.
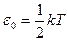 .
.
Если молекула состоит из двух и более атомов, полное число степеней свободы i увеличивается:
i=iпост+iвр.
При этом в тепловом равновесии на каждую степень свободы по-прежнему будет приходиться энергияe0. Таким образом, с учетом возможности вращательного движения сложных молекул средняя энергия e движения одной молекулы равна:
 , i=iпост+iвр.
, i=iпост+iвр.
Из сказанного ясно, что энергия движения двухатомных молекул равна 5kT/2 (iвр=2), а трех и более атомных молекул - 3kT (iвр=3).
Внутренняя энергия идеального газа. Как уже говорилось, расстояние между молекулами газа при нормальных условиях примерно в 10 раз больше характерного размера молекул. Это означает, что молекулы находятся далеко друг от друга и силой взаимодействия между ними, а следовательно энергией их взаимодействия, можно пренебречь. Именно такая модель невзаимодействующих молекул соответствует идеальному газу.
Внутренняя энергия идеального газа представляет собой суммарную кинетическую энергию всех молекул данной массы газа.
Средняя кинетическая энергия одной молекулы равна < e0>=ikT/2, где i - число степеней свободы:
i =3 - для газов, молекулы которых состоят из одного атома и не имеют вращательных степеней свободы (это имеет место для всех инертных газов, например He;
i =5 - для O2, N2, H2 и большинства других простых газов, имеющих двухатомные молекулы;
i =6 - для CO2, паров воды H2O) и других газов, имеющих трех-и более атомные молекулы.
Поскольку в одном моле газа содержится Nа молекул, внутренняя энергия одного моля газа равна:
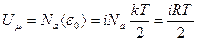 . (1.20)
. (1.20)
Если масса газа равна m, это составляет n=m/m молей. Следовательно, внутреняя энергия U m массы m газа определится формулой:
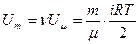 . (1.21)
. (1.21)
Важно! Внутренняя энергия идеального газа зависит только от температуры и не меняется при изменении объема и давления (если при этом T=const).
В случае других веществ и реальных газов (сжатые до p =100 атм. и более при комнатной температуре газы) ситуация другая. Поскольку концентрация молекул n=p/(kT) возрастает с ростом давления, то объем V1=1/n, приходящийся на одну молекулу, становится сравнимым с объемом самой молекулы. Молекулы сильно сближаются и становится существенной энергия взаимодействия между ними (потенциальная энергия). В этих условиях внутренняя энергия будет зависеть и от расстояния между молекулами, т.е. от объема газа.
Date: 2015-05-09; view: 1354; Нарушение авторских прав