
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Применение первого начала термодинамики к изопроцессам в идеальном газе
|
|
Для равновесных процессов, протекающих в газах, элементарная работа, производимая газом против внешних сил, состоит в работе расширения (2.1), поэтому первое начало термодинамики может быть записано в виде:
dQ=dU+p×dV
Изохорный процесс (V=const). В этом случае, как уже отмечалось, работа, совершаемая газом против внешней силы, равна нулю. Первое начало термодинамики для изохорного процесса примет вид:
dQ=dU (2.7)
Таким образом, в изохорном процессе вся теплота, подведенная к газу, идет на увеличение его внутренней энергии. Используя уравнение (2.5), выразим изменение теплоты dQ через изменение температуры dT
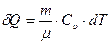 ,
,
где Сu - молярная теплоемкость газа при постоянном объеме. Согласно (2.7) приращение внутренней энергии при этом процессе примет вид:
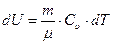 , или
, или 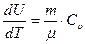 . (2.8)
. (2.8)
С другой стороны ранее было получено выражение для внутренней энергии идеального газа в зависимости от числа i степеней свободы составляющих его молекул: U=i mRT/(2m). Продифференцировав это соотношение по T, получим формулу:
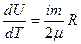 , (2.9)
, (2.9)
сравнивая которую с (2.8), получим выражение для Cu:
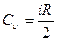 (2.10)
(2.10)
Таким образом, молярная теплоемкость при постоянном давлении для идеального газа не зависит от термодинамических параметров, а определяется характером газа (числом степеней свободы молекул).
Изобарный процесс (p=const). Примером изобарного процесса может служить процесс теплообмена с газом, находящимся в цилиндре под поршнем (рис.2.1), нагруженным постоянной внешней силой. В соответствии с (2.2) работа, совершаемая газом против внешней силы, равна:
Ар=р×(V2-V1) (2.11)
и может быть найдена как площадь фигуры под линией изобары, которая в координатах (p,V) имеет вид прямоугольника. Уравнение первого начала термодинамики для изобарного процесса имеет вид (2.6), в котором давление следует считать постоянным.
Если обозначить через Ср молярную теплоемкость газа процесса, протекающего при постоянном давлении, то согласно (2.5) выражение для притока тепла при изобарическом нагревании можно записать в виде:
 . (2.12)
. (2.12)
Приравнивая правые части соотношений (2.6) и (2.12), получим:
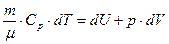
и делением обеих частей равенства на m dT/m преобразуем эту формулу к виду:
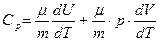 . (2.13)
. (2.13)
Значение производной dU/dT, входящей в правую часть полученного равенства, можно подставить из формулы (2.9). При вычислении dV/dT можно воспользоваться уравнением состояния pV=m/m RT, но необходимо помнить, что процесс изобарический (p=const). В результате dV/dT=mR/(mp) и выражение (2.13) перейдет в следующее:
Сp=Cu+R (2.14)
Это соотношение называется уравнением Майера. Из него следует, что теплоемкость при изобарическом нагревании всегда больше такого же процесса, происходящего при постоянном объеме (Ср>Cu). Уравнение Майера справедливо в случае идеального газа, но вывод, что (Ср>Cu) имеет место в случае любых газов и многих других систем. Он обязан способности тел расширяться при нагревании. При изохорном нагревании подведенная теплота идет только на увеличение внутренней энергии системы, а при изобарном процессе дополнительно затрачивается на работу, производимую телом при его расширении против сил внешнего давления. Поэтому для нагревания на один градус в изобарическом процессе требуется затратить большее количество тепла, а процесс имеет большую теплоемкость.
Таким образом, молярная теплоемкость Cр идеального газа в процессе изобарического нагревания тоже не зависит от термодинамических параметров:
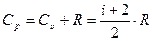 (2.15)
(2.15)
и количество теплоты при изобарном нагревании от температуры T1 до T2 может быть подсчитано как:
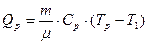 .
.
Изотермический процесс (T=const). Согласно первому началу термодинамики для любого процесса справедливо:
Q=DU+A
Для идеального газа внутренняя энергия U$ определяется его температурой T, следовательно для изотермического процесса (поскольку DT=0 и DU=0) первое начало дает:
QT=A. (2.16)
Таким образом, при изотермическом процессе вся подведенная теплота расходуется на совершение работы газа. При этом подвод тепла не приводит к изменению температуры газа. Теплоемкость газа в таком процессе бесконечна (CТ= 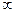 ). Действительно, какое бы ни было большое количество тепла подведено к газу, изменить его температуру (даже на один градус) не удастся (поскольку T=const).
). Действительно, какое бы ни было большое количество тепла подведено к газу, изменить его температуру (даже на один градус) не удастся (поскольку T=const).
Найдем работу расширения газа при изотермическом процессе. В соответствии с формулой (2.2)
 .
.
Воспользовавшись уравнением состояния идеального газа найдем закон изменения давления:
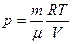 ,
,
который подставим под знак интеграла и вынесем постоянные за знак интегрирования (T=const):
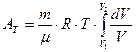 .
.
После интегрирования будем иметь:
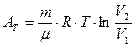 , причем QT=AT. (2.17)
, причем QT=AT. (2.17)
Во всех рассмотренных процессах мы рассматривали ситуацию, когда теплота подводится к газу (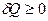 ). В этом случае газ нагревается (
). В этом случае газ нагревается (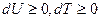 ), расширяется (
), расширяется (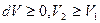 ) и совершает работу (
) и совершает работу (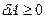 ). Однако полученные при этом формулы сохраняют свой вид и в обратном процессе сжатия и охлаждения газа. В последнем случае все перечисленные величины имеют ту же абсолютную величину, но обратный знак. Это означает, что для сжатия газа необходимо совершать работу внешними силами (над газом), а тепло газом отдается другим телам.
). Однако полученные при этом формулы сохраняют свой вид и в обратном процессе сжатия и охлаждения газа. В последнем случае все перечисленные величины имеют ту же абсолютную величину, но обратный знак. Это означает, что для сжатия газа необходимо совершать работу внешними силами (над газом), а тепло газом отдается другим телам.
Date: 2015-05-09; view: 1588; Нарушение авторских прав