
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Экспериментальные газовые законы
|
|
Состояние некоторой массы газа характеризуется следующими термодинамическими параметрами: объемом (V), давлением (p) и температурой (T). Перечислим кратко изопроцессы, происходящие в газах, то есть такие процессы, которые протекают при одном фиксированном параметре.
Изотермический процесс (T=const) описывается законом Бойля - Мариотта, установленным на основании экспериментов:
при изотермическом процессе произведение давления на объем для данной массы газа (m=const) есть величина постоянная, т.е.
pV=const
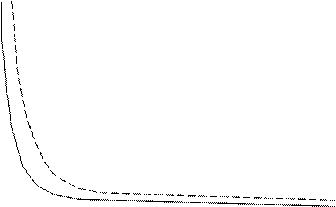
График изотермического процесса в координатах { p,V } представляет собой гиперболу и носит название изотермы (рис. 1.3).
Изобарический процесс - процесс, при котором изменение состояния газа происходит при постоянном давлении (p=const). Такой процесс описывается законом Гей-Люссака, который также был установлен опытным путем:
при изобарическом процессе объем данной массы газа (m=const) пропорционален абсолютной температуре (температуре по шкале Кельвина)
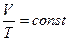 .
.
 | |||
 | |||
Р -
Т2
Т1
 0 V
0 V
Рис. 1.3. График изотермического процесса. сплошная линия – процесс при температуре Т1, пунктир соответствует температуре Т2.
График этого процесса представляет собой прямую линию (рис. 1.4). На оси температур указаны также градусы по шкале Цельсия. На вертикальной оси не указаны конкретные значения, поскольку они будут зависеть от массы m и вида данного газа. В таком виде график качественно описывает любое количество любого газа.
Изохорический процесс - процесс, когда изменение состояния газа происходит при постоянном объеме (V=const). Такой процесс описывается опытным законом Шарля: при изохорическом процессе давление данной массы газа (m=const) пропорционально температуре по шкале Кельвина:
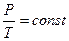 .
.
График этого процесса изображен на рис. (1.5) и представляет собой прямую линию, продолжение которой выходит из начала координат.
 V
V
 p2
p2
p1


 -
- 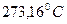
 t
t
0 T
273,16К
Рис. 1.4. График изобарического процесса в координатах {V,T}. Сплошная линия – процесс при давлении р1, пунктир соответствует процессу при давлении р2.
 р
р
 V2
V2
V1


 -
- 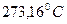
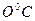 t
t
0 273,16 К T
Рис. 1.5. График изохорического процесса в координатах {p,Т}. Сплошная линия – процесс при объеме V1, пунктир соответствует процессу при объеме V2.
Важно, что независимо от массы, вида и давления, при котором происходит процесс, продолжение графиков пересечет ось температур в точке  , что позволяет принять эту точку за начало отсчета температуры по шкале Кельвина. Эта шкала температур является абсолютной, в частности потому, что она не связана с каким-либо определенным термометрическим веществом.[1]
, что позволяет принять эту точку за начало отсчета температуры по шкале Кельвина. Эта шкала температур является абсолютной, в частности потому, что она не связана с каким-либо определенным термометрическим веществом.[1]
Date: 2015-05-09; view: 1246; Нарушение авторских прав